题目内容
【题目】实验室用碳酸钠溶液与氯化钙溶液反应制取高纯度碳酸钙粉末,烧杯中现有100g碳酸钠溶液,将140g氯化钙溶液分四次加入,充分反应,
注:发生反应的化学方程式为![]()
四次测量所得数据如表所示:
次数 | 累计加入氯化钙溶液的质量/g | 烧杯中溶液的总质量/g |
一 | 40 | 135 |
二 | 80 | 170 |
三 | 120 | 205 |
四 | 140 | 225 |
(1)恰好完全反应时,生成沉淀的总质量为 g。
(2)第四次测量时,所得溶液中的溶质有 (填化学式)。
(3)计算氯化钙溶液的溶质质量分数(写出计算过程,计算结果保留到0.1%)
【答案】(1)15;(2)NaCl和CaCl2;(3)13.9%
【解析】
(1)碳酸钠和氯化钙反应生成碳酸钙和氯化钠,减少的质量的即为反应生成的碳酸钙沉淀的质量,第一次测量总质量减少的质量为![]() ,第二次测量总质量减少的质量为
,第二次测量总质量减少的质量为![]() ,第三次测量总质量减少的质量为
,第三次测量总质量减少的质量为![]() ,第四次测量总质量减少的质量为
,第四次测量总质量减少的质量为![]() ,故恰好完全反应时,生成沉淀的总质量为15g。
,故恰好完全反应时,生成沉淀的总质量为15g。
(2)碳酸钠和氯化钙反应生成碳酸钙和氯化钠,第四次测量时,氯化钙过量,所得溶液中的溶质有生成的氯化钠和过量的氯化钙,化学式为NaCl和CaCl2。
(3)设80g氯化钙溶液的溶质质量为x
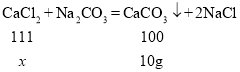
![]()
![]()
氯化钙溶液的溶质质量分数为![]()
答:(1)恰好完全反应时,生成沉淀的总质量为15g;
(2)第四次测量时,所得溶液中的溶质有NaCl和CaCl2;
(3)氯化钙溶液的溶质质量分数为13.9%。

【题目】生石灰常用作食品干燥剂,干燥剂的包装袋上除了标明主要成分为生石灰外,还提醒人们注意:不可食用、不可浸水、不可开袋、不可玩耍、儿童勿取。
(1)同学们将一袋 干燥剂倒入一定 量的水中,发现生石灰开始“沸腾”,咕嘟咕嘟冒泡,不时有水蒸汽冒出,充分搅拌后过滤,得到白色沉淀和滤液。通过实验现象可知生石灰遇水会_____________(选填“吸热”或“放热”),写出有关反应的化学方程式:_________________。
(2)同学们想知道所得白色沉淀的成分,进行了如下探究:
[提出问题]白色沉淀中含有哪些物质?
[猜想假设]猜想1:只含有氢氧化钙;
猜想2:只含碳酸钙;
猜想3:_________________。
[实验探究]同学们进行了如下表所示的实验,请将下表填写完整;
实验步骤 | 现象现象 | 结论 |
I.取少量样品于试管中,加入足量的稀盐酸 | ______________ | 猜想1不成立 |
II.另取少量样品于试管中,加入适量水,充分搅拌后,滴加______________________ | 溶液呈红色 | 猜想3成立 |
[拓展延伸]①写出步骤I中发生反应的化学方程式:_________________。
②实验室正确保存生石灰的方法是_________________。