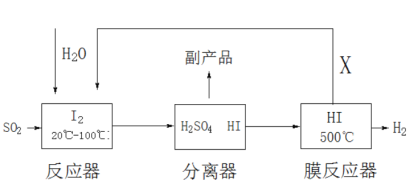
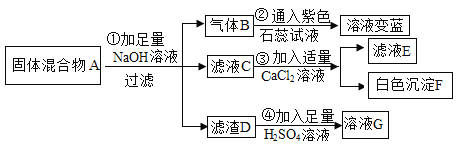
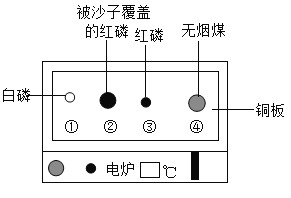
题目内容
【题目】(1)用化学用语填空
铵根离子_________;氢氧化铝中铝元素的化合价________ 。
(2)量取18.0mL蒸馏水最好选用的量筒规格是_________(填序号)。
A 5mL B 10mL C 25mL D 100mL
(3)质量为50g溶质质量分数为20%的氢氧化钾溶液和质量为50g溶质质量分数为20%的稀硫酸混合,所得溶液的PH_____7(填“>”或“=”或“<”)
(4)现有A、B两种溶液中,共含有Na+、H+、Ag+、Ba2+、NO3-、Cl-、CO32-七种离子,已知A溶液中含有三种阳离子和一种阴离子,则B溶液中所含的离子是__________,取少量A溶液滴入NaCl溶液至不再有沉淀生成后过滤,将此滤液加入B溶液中,则一定能看到的现象是_______。
【答案】NH4+ ![]() C < CO32-、Na+ 、Cl- 有气泡产生
C < CO32-、Na+ 、Cl- 有气泡产生
【解析】
(1)铵根离子带一个单位正电荷:NH4+;设氯元素化合价为x,则x+(-1)×3=0,则x=+3,氢氧化铝中铝元素的化合价为+3价,表示:![]() 。
。
(2)量取18.0mL蒸馏水最好选用的量筒规格(稍大于液体体积,测量更加准确)是:25mL。
故选:C。
(3)质量为50g溶质质量分数为20%的氢氧化钾溶液中溶质质量=50g×20%=10g,和质量为50g溶质质量分数为20%的稀硫酸溶质质量=50g×20%=10g混合,等质量的氢氧化钾与硫酸反应,2KOH+H2SO4=K2SO4+2H2O,2个氢氧化钾的相对分子质量112,1个硫酸的相对分子质量为98,相对分子质量小,则该物质有剩余,所以硫酸有剩余,显酸性,所得溶液的PH<7;
(4)现有A、B两种溶液中,共含有Na+、H+、Ag+、Ba2+、NO3-、Cl-、CO32-七种离子,已知A溶液中含有三种阳离子和一种阴离子,则该阴离子一定不是碳酸根,因为碳酸根与氢离子和钡离子以及银离子都不共存;若A溶液中的阴离子是氯离子,氯离子与银离子不共存,则A中阳离子可能是钠离子、氢离子和钡离子,B溶液中含有碳酸根离子和银离子以及硝酸根,其中碳酸根与银离子不共存,所以A溶液中的阴离子一定是硝酸根,阳离子是氢离子、银离子、钡离子,则B溶液中所含的离子是:钠离子、碳酸根、氯离子;取少量A溶液滴入NaCl溶液,银离子与氯离子反应产生氯化银白色沉淀,过滤后,将此滤液加入B溶液中,A溶液中的氢离子与B溶液中碳酸根离子反应产生二氧化碳气体,则一定能看到的现象是:有气泡产生。