题目内容
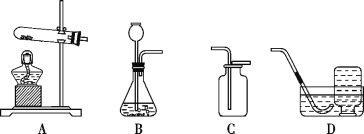
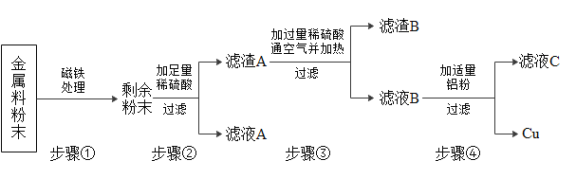
【题目】用如图装置进行实验。升温至60℃的过程中,仅①燃烧;继续升温至260℃的过程中,仅③燃烧。
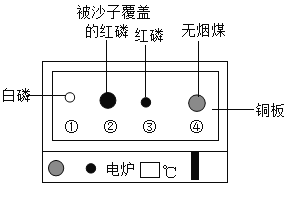
(1)红磷燃烧的化学方程式为_______________。
(2)实验过程中,能说明可燃物燃烧需要温度达到着火点的现象是________________。
(3)升温至260℃时,对比___________的实验现象,能证明可燃物燃烧的另一个条件。
(4)实验过程中,欲使②中的红磷燃烧,应进行的操作是_____________________。
【答案】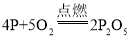 升温至60℃,①燃烧,③不燃烧 ②③ 加热到260℃时,拨开沙子
升温至60℃,①燃烧,③不燃烧 ②③ 加热到260℃时,拨开沙子
【解析】
本题探究燃烧的条件。
(1)红磷燃烧的化学方程式为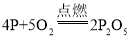 。
。
(2)实验过程中,当温度升到60℃时,白磷燃烧,红磷不燃烧,说明温度达到了白磷的着火点,温度没有达到红磷的着火点。这说明可燃物燃烧需要温度达到着火点。
(3)升温至260℃时,③的红磷燃烧,②的红磷没有燃烧,因为②的红磷被沙子覆盖,隔绝了空气。对比②③的实验现象,证明可燃物燃烧的另一个条件需要与氧气接触。
(4)实验过程中,欲使②中的红磷燃烧,温度要达到着火点且要与氧气接触。应进行的操作是加热到260℃时,拨开沙子。

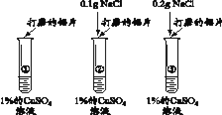
【题目】某实验小组同学欲通过实验探究金属的性质。
【实验目的】证明金属活动性强弱:Al > Cu
【设计并实施实验】小组内的3位同学分别做了下述实验:
实验 | 现象 | |
甲 | 将铝片直接放入到稀CuCl2溶液中 | 一段时间后才出现了预期的实验现象 |
乙 | 将用砂纸打磨过的铝片放入稀CuCl2溶液(与甲实验浓度相同)中 | 十几秒内即观察到明显现象。 |
丙 | 将用砂纸打磨过的铝片放入稀CuSO4溶液中 | 在与乙相同的时间内没有观察到明显现象 |
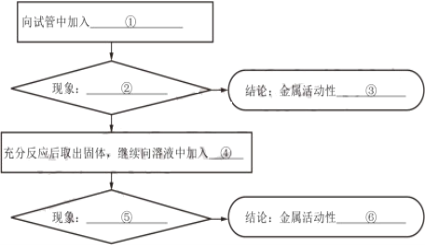
(1)实验中,预期的实验现象是________。
(2)对比甲、乙两位同学的实验,推测甲同学开始时没有观察到明显实验现象的原因是________。
该小组同学进一步对实验进行探究。
【提出问题】为什么打磨过的铝片放入到CuCl2溶液和CuSO4溶液中观察到的现象不同呢?
【微观探析】查阅资料可知两个反应的微观示意图如下。

(3)图1反应的化学方程式为________;Al和CuCl2溶液、CuSO4溶液反应的微观本质是Al和Cu2+反应生成 Al3+和______ 。
【提出猜想】根据上述图示,小组同学提出了如下猜想。
猜想1:产生现象不同的原因是CuCl2溶液比CuSO4溶液中含有的Cu2+浓度大。
猜想2:溶液中Cl-对Al和Cu2+反应有促进作用。
猜想3:溶液中SO42-对Al和Cu2+反应有阻碍作用。
【设计并实施实验】
序号 | 实验方案及操作 | 现象 | 结论 |
1 | 乙、丙两位同学取Cu2+浓度相同的CuCl2溶液和CuSO4溶液重复实验。 | 与上述乙、丙同学实验现象相同 | 猜想1______(填“成立”或“不成立”) |
2 |
| 在同一时间内,③最快产生现象,②次之,①无明显现象 | 猜想2成立 |
(5)甲同学认为通过实验2得到的结论证据不充足,其理由是溶液中的__________ 对实验可能有干扰。
(6)丙同学通过查阅资料排除了上述干扰,并模仿实验2又设计了一组3支试管的实验,证明了猜想3也成立。请在下列方框中画出实验设计图示。__________