题目内容
【题目】实验室制取二氧化硫的反应式为:Na2SO3+H2SO4(浓)=Na2SO4+H2O+SO2↑
(1)用189g亚硫酸钠与过量硫酸反应,试求最多可生成二氧化硫的质量是多少_____?(请在答题卡上写出计算过程)
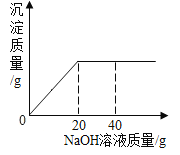
(2)测得上述反应完成后的残留混合物中含有49gH2SO4,若用含Ca(OH)292.5%的熟石灰(所含杂质不与硫酸反应)进行中和处理,请在如图坐标中自行设定纵坐标为溶液中某种物质(盐或酸)的质量,画出其随熟石灰加入而变化的曲线图(______)图中须标出必要的数据)。
(3)实验室也能用铜与浓硫酸反应制备二氧化硫,反应的化学方程式为:Cu+2H2SO4 (浓)![]() CuSO4+2H2O+SO2↑.若用100g 98%的浓硫酸与过量的铜充分反应,生成二氧化硫的质量_____(填“>”、“=”或“<”)32g,原因是_____。
CuSO4+2H2O+SO2↑.若用100g 98%的浓硫酸与过量的铜充分反应,生成二氧化硫的质量_____(填“>”、“=”或“<”)32g,原因是_____。
【答案】96g 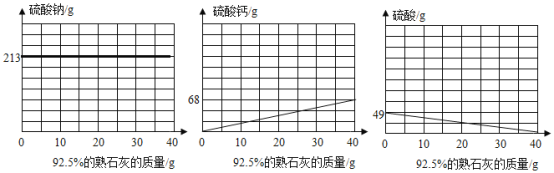 < 因为硫酸越来越稀,不能和铜继续反应,也就得不到二氧化硫
< 因为硫酸越来越稀,不能和铜继续反应,也就得不到二氧化硫
【解析】
(1)根据亚硫酸钠的质量和对应的化学方程式求算生成的二氧化硫的质量以及硫酸钠的质量(为第二步准备);
(2)根据硫酸的质量和对应的化学方程式求算消耗的含Ca(OH)292.5%的熟石灰的质量以及生成的硫酸钙的质量,进而画图;
(3)由于只有浓硫酸才能和铜反应生成二氧化硫,所以据此分析和判断。
(1)用189g亚硫酸钠与过量硫酸反应,设生成二氧化硫的质量为x,生成的硫酸钠的质量为y
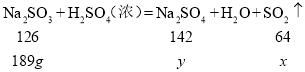
![]()
x=96g
y=213g
(2)设消耗的含Ca(OH)292.5%的熟石灰的质量为z,生成的硫酸钙的质量为a
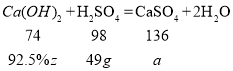
![]()
a=68g
z=40g
如图坐标中自行设定纵坐标为溶液中某种物质(盐或酸)的质量,画出其随熟石灰加入而变化的曲线图。
由于开始的混合物含有硫酸钠,过程中质量不变,所以可得图1;
硫酸钙是过程中生成的,最后质量为68g,所以质量增加,到加入40g熟石灰时达到最大;
硫酸时反应物,开始是49g,随着反应进行越来越少,到加入40g熟石灰时达到0。
得图为(绘制任一图均可):

(3)实验室也能用铜与浓硫酸反应制备二氧化硫,是铜和浓硫酸反应,而稀硫酸不能和铜反应更不会得到二氧化硫,所以若用100g 98%的浓硫酸与过量的铜充分反应,生成二氧化硫的质量<32g,原因是 因为硫酸越来越稀,不能和铜继续反应,也就得不到二氧化硫。

 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案【题目】物质的组成、结构、性质与制备
(1)物质的组成和结构决定了物质的性质。请你利用已有的化学知识完成下表并填空
物质的名称(或俗称) | 构成物质的微粒符号 | 体现物质化学性质的变化(用方程式表示,写一个即可) |
_________ | Na+、OH- | _________ |
乙醇 | _________ | _________ |
铜 | _________ | _________ |
上表你列举的体现物质化学性质的反应中,包含的基本反应类型有______。
(2)利用物质的性质可以检验或鉴别物质。实验室有一瓶失去标鉴的溶液,为了鉴别其是稀盐酸还是氯化镁溶液,小组同学选用不同的试剂进行实验,都将其鉴别了出来。
可供选择的试剂:银片、生锈的铁钉、块状石灰石、二氧化碳、硝酸银溶液、澄清的石灰水
请按要求填写下表(只填写检验过程中可观察到明显现象的化学变化方程式)
检验过程中发生化学变化的方程式 | 运用物质的性质 |
_________ | 盐能与某些碱反应 |
_________ | _________ |
_________ | _________ |
(3)利用物质的性质可通过化学变化制备物质胆矾(CuSO4·5H2O)在工农业生产中有广泛的用途。实验室利用废旧电池的铜棒(主要含铜和锌)为原料制备胆矾。实验流程如图所示:查阅资料:氧化锌能溶于氢氧化钠溶液。
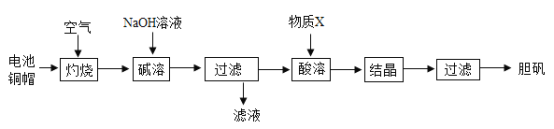
①废旧电池钢帽的表面常有油污,可用洗洁精预先除去,洗洁精在除去油污的过程中起____________作用。
②“碱溶”步骤中,为加快反应速率可采取多种措施,如搅拌、______、______等。
③“酸溶”时,发生反应的化学方程式是_____________。
④试写出胆况在工农业生产中的一种用途_______________.