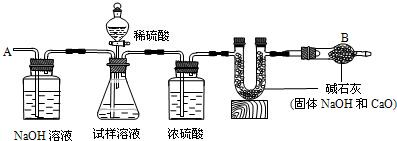
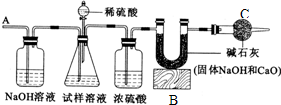
题目内容
(4.5分) 10g石灰石与100g盐酸恰好完全反应,生成CO2质量为2.2g,求:
(1)石灰石中CaCO3的质量分数;
(2)反应后所得溶液中溶质质量分数是多少?
50% 5.4%
解析试题分析:(1)、解:设石灰中的CaCO3的质量为X。
CaCO3+2HCl=CaCl+H2O+CO2
100 44
X 2.2g
100/44=X/2.2g
X=5g
CaCO3%=(5g/10g)×100%=50%
(2)、解:设反应后生成CaCI2的质量为y
CaCO3+2HCl=CaCl2+H2O+CO2
100 111
5g y
100/111=5g/y
y=5.55g
溶液总质量:10g+100g-2.2g-(10g-5g)=102.8g
CaCl2%=5.55g/102.8g≈5.4%
答:(1)石灰石中CaCO3的质量分数为50%;
(2)反应后所得溶液中溶质质量分数是5.4%。
考点:根据化学方程式计算;溶液中溶质数量分数。
点评:根据化学方程式计算,要注意解题的步骤,设、写、找、列、解、答。
溶质质量分数=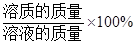 。
。

练习册系列答案
相关题目
氧化物、酸、碱、盐都是重要的无机化合物.请按要求回答下列一系列相关的问题.
(1)产生下列现象,只和空气中的水蒸气有关的是
A.固体烧碱要密封存放
B.生石灰长期在空气中放置会变质
C.浓硫酸露置于空气中会增重、变稀
D.铁制品放在潮湿空气中会生锈
(2)以下是一些食物的近似pH,对于胃酸过多的人比较适宜的食物是
(3)根据“性质决定用途,用途体现性质”回答下列问题.
A.稀释浓硫酸时,为什么不可将水倒进浓硫酸里?请简要解释其原因.
B.盐酸等许多酸都能使紫色石蕊试液变红,为什么?
C.写出用稀盐酸除水垢(主要成分是碳酸钙)的化学方程式.
(4)三支试管中分别装有少量白色固体,它们分别是氯化钠、氢氧化钠、碳酸钙中的一种,只要加入足量的 就能将它们一次性鉴别出来;盐酸(分析纯)化学式HCl质量分数36%密度l.18g/cm3
(5)实验操作考试时某同学做了如下两个实验:①氧化铜与稀硫酸反应;②烧碱溶液与酚酞溶液反应.实验结束后,该同学发现废液缸中有蓝色沉淀.请你写出有蓝色沉淀生成的反应的化学方程式是 .
(6)右图是浓盐酸试剂瓶上标签的部分内容.请回答:
A.现要配制9%的稀盐酸120g,需要这种浓盐酸 g;
B.浓盐酸使用一段时间后溶质质量分数变小的原因是什么?
C.某固体氢氧化钠在空气中敞口放置一段时间后部分变质,将该固体取10g加入质量分数为9%的盐酸至不再产生气泡为止,共产生气体质量为2.2g,试计算未变质的氢氧化钠的质量为多少克?
(1)产生下列现象,只和空气中的水蒸气有关的是
A.固体烧碱要密封存放
B.生石灰长期在空气中放置会变质
C.浓硫酸露置于空气中会增重、变稀
D.铁制品放在潮湿空气中会生锈
(2)以下是一些食物的近似pH,对于胃酸过多的人比较适宜的食物是
| 选项 | A | B | C | D |
| 物质 | 橘子 | 泡菜 | 葡萄 | 玉米粥 |
| pH | 2.9~3.5 | 3.0~4.0 | 3.5~4.5 | 6.8-8.0 |
A.稀释浓硫酸时,为什么不可将水倒进浓硫酸里?请简要解释其原因.
B.盐酸等许多酸都能使紫色石蕊试液变红,为什么?
C.写出用稀盐酸除水垢(主要成分是碳酸钙)的化学方程式.
(4)三支试管中分别装有少量白色固体,它们分别是氯化钠、氢氧化钠、碳酸钙中的一种,只要加入足量的
(5)实验操作考试时某同学做了如下两个实验:①氧化铜与稀硫酸反应;②烧碱溶液与酚酞溶液反应.实验结束后,该同学发现废液缸中有蓝色沉淀.请你写出有蓝色沉淀生成的反应的化学方程式是
(6)右图是浓盐酸试剂瓶上标签的部分内容.请回答:
A.现要配制9%的稀盐酸120g,需要这种浓盐酸
B.浓盐酸使用一段时间后溶质质量分数变小的原因是什么?
C.某固体氢氧化钠在空气中敞口放置一段时间后部分变质,将该固体取10g加入质量分数为9%的盐酸至不再产生气泡为止,共产生气体质量为2.2g,试计算未变质的氢氧化钠的质量为多少克?