题目内容
【题目】铁及其化合物在生产生活中应用广泛。
(一)铁的化合物制备
用废铁屑制备铁红( 主要成分为 Fe2O3)和 K2SO4 的部分流程如下图所示:
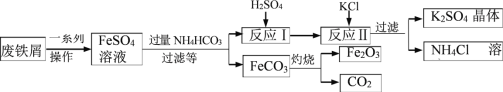
(1)加过量 NH4HCO3 反应时温度不宜过高的原因为 _____。
(2)反应Ⅰ生成的气体化学式是 _____;K2SO4 和 NH4Cl 在农业生产中都可做 _____。
(3)为检验 K2SO4 中是否混有 Cl-,要先加入足量 _____溶液,静置后再加向上层清液中滴加少量 _____溶液。
(4)在空气中灼烧 FeCO3 的化学方程式为 _____。
(二)铁的冶炼和探究
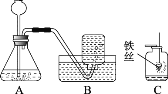
取 29.0g Fe2O3 粉末,小组同学用下图装置模拟炼铁,并测定反应后固体成分。
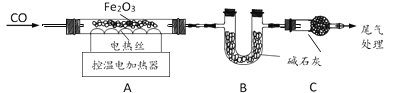
资料:碱石灰可吸收 H2O 和 CO2。
(1)连接装置,先______,再装入药品。
(2)实验时先通入 CO,目的是______。
(3)通过测定装置B 中固体质量变化情况,可求得A 中剩余固体质量,装置C 的作用是______。
(4)现直接测得装置A 中剩余固体质量为 21.0g,则装置 B 中固体应增重______g。
【答案】碳酸氢铵受热分解 CO2 化肥 Ba(NO3)2 AgNO3 4FeCO3+O2![]() 2Fe2O3+4CO2 检查装置气密性 排尽装置内的空气防止加热时发生爆炸 防止空气中的二氧化碳和水进入到B 中 22
2Fe2O3+4CO2 检查装置气密性 排尽装置内的空气防止加热时发生爆炸 防止空气中的二氧化碳和水进入到B 中 22
【解析】
(一)(1)由于碳酸氢铵受热易分解,所以加过量NH4HCO3反应时温度不宜过高的原因为 防止NH4HCO3受热分解。
(2)反应Ⅰ是剩余的碳酸氢铵和硫酸反应,所以反应I中生成的气体化学式是 CO2;K2SO4和NH4Cl在农业生产中都可做化肥。
(3)为检验K2SO4中是否混有Cl-,要先加入足量 Ba(NO3)2溶液,静置后再加向上层清液中滴加少量AgNO3溶液。
(4)在空气中灼烧FeCO3的,由于生成了氧化铁,即铁元素化合价升高,所以必须和氧化剂反应,而空气中的氧化剂最可能是氧气,即碳酸亚铁和氧气在加热的条件下生成氧化铁和二氧化碳,对应的化学方程式为 4FeCO3+O2![]() 2Fe2O3+4CO2。
2Fe2O3+4CO2。
(二)(1)连接装置,先检查装置气密性,再装入药品。
故填:检查装置气密性。
(2)实验时先通入 CO,目的是排尽装置内的空气防止加热时发生爆炸。
故填:排尽装置内的空气防止加热时发生爆炸。
(4)装置C的作用是:防止空气中的水蒸气和二氧化碳进入B装置中,影响实验结果。
故填:防止空气中的水蒸气和二氧化碳进入B装置中。
(5)由于反应生成的二氧化碳中,氧元素一半来自于铁的氧化物,一半来自于一氧化碳,因此反应生成二氧化碳质量为:(29.0g-21.0g)÷![]() ×2=22g,因此装置B中固体应增重22g。
×2=22g,因此装置B中固体应增重22g。
故填:22。

【题目】干燥剂“碱石灰”是氧化钙和氢氧化钠的混合物,在空气中容易变质。某研究 小组对一只干燥管里的碱石灰样品的成分进行实验探究。
(提出猜想) 猜想Ⅰ:没有变质,只含有氧化钙和氢氧化钠; 猜想Ⅱ:已经变质,可能情况未知;猜想Ⅲ:完全变质,且只含有碳酸钙和碳酸钠;
(实验探究)
(1)取样品,加入几滴清水,试管外壁不发烫;
(2)取样品,加入足量清水和几滴酚酞溶液,充分搅拌并过滤,得到白色沉淀和红色滤液;
(分析过程)
根据实验(1)说明猜想_____(填“Ⅰ”、“Ⅱ”或“Ⅲ”)不成立。根据实 验(2)甲同学认为猜想Ⅲ成立,乙同学不同意,他认为碱石灰样品中不一定含有碳酸钙, 可能含有氢氧化钙,他的理由是_________(请写化学方程式)。
为进一步确定猜想,他们设计了以下实验方案:
实验方案 | 实验现象 | 分析 |
①取红色滤液,通入一定_____ 量的 CO2 气体 | 若产生_______ | 滤液中含有 Ca(OH)2 |
②取红色滤液,加入过量 的_____溶液 | 若产生白色沉淀,溶液仍然呈红色 | 滤液中含有_______ |
若产生白色沉淀,溶液呈无色 | 滤液中只含 Na2CO3 |
(实验结论)甲、乙同学完成设计的实验方案后,证明了猜想Ⅱ成立。
(实验反思)根据上述实验,下列说法正确的是_____(填序号)。
A 过滤后得到的红色滤液中的溶质只有 3 种可能的组合
B 表格中的方案①,若通入的 CO2 适量,溶液可能由红色变成无色
C 实验证明了原碱石灰样品中一定不含 CaCO3
D 根据实验可知,碱石灰样品的变质情况有 2 种可能性