题目内容
【题目】下图为实验室中常用装置。
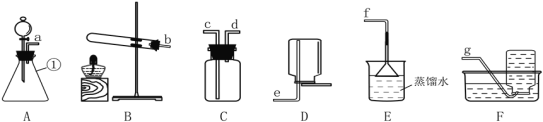
请回答下列问题:
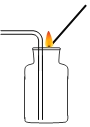
(1)实验室用高锰酸钾制取并收集较纯净的氧气所选用的装置是_____(填装置字母),该反应的化学方程式为__。二氧化锰直接排放会造成环境污染。从充分加热后的上述剩余固体中回收二氧化锰的方法是______、过滤、洗涤和烘干(注:锰酸钾可溶于水)。
(2)夏天温度高,检查装置B的气密性,方法是:连接好仪器,把导管一端放入水中,然后___,观察到有气泡冒出,说明装置气密性良好。
(3)实验室常用锌粒和稀硫酸制取氢气,其反应的化学方程式:______。
(4)实验室制取二氧化碳的化学方程式是______,发生装置选取A的优点_____,若实验室需要制取88g的二氧化碳,则最少需要含80%CaCO3的大理石____g。
(5)通常状况下,氨气是一种无色、有强烈刺激性气味的污染性气体,极易溶解于水形成氨水,相同条件下密度比空气小。常温下实验室可以用浓氨水与生石灰制取氨气。请从上图中选出合适的仪器连接成一套制备并收集氨气的装置,则装置的接口连接顺序是a→____→f,上述实验中,E装置的作用是_____。
【答案】BF 2KMnO4![]() K2MnO4+MnO2+O2↑ 溶解 用热毛巾包裹试管或用酒精灯稍加热试管 Zn+H2SO4=ZnSO4+H2↑ CaCO3+2HCl=CaCl2+H2O+CO2↑ 随时控制反应的开始与停止 250 dc(全对才有分) 吸收氨气防止污染空气
K2MnO4+MnO2+O2↑ 溶解 用热毛巾包裹试管或用酒精灯稍加热试管 Zn+H2SO4=ZnSO4+H2↑ CaCO3+2HCl=CaCl2+H2O+CO2↑ 随时控制反应的开始与停止 250 dc(全对才有分) 吸收氨气防止污染空气
【解析】
加热高锰酸钾属于固体加热型,生成锰酸钾和二氧化锰和氧气,收集纯净氧气用排水法,干燥氧气用向上排空气法,锰酸钾可溶于水,据此可以分离二氧化锰,锌粒和稀硫酸反应生成硫酸锌和氢气,实验室制取二氧化碳,用石灰石和盐酸反应生成氯化钙和水和二氧化碳,氨气是一种无色、有强烈刺激性气味的污染性气体,极易溶解于水形成氨水,相同条件下密度比空气小,故用向下排空气法收集氨气,常温下实验室可以用浓氨水与生石灰制取氨气,氨气污染环境,须用水吸收。
(1)加热高锰酸钾属于固体加热型,生成锰酸钾和二氧化锰和氧气,故实验室用高锰酸钾制取并收集较纯净的氧气所选用的装置是BF,化学方程式为![]() ,从充分加热后的上述剩余固体中回收二氧化锰的方法是溶解、过滤、洗涤和烘干。
,从充分加热后的上述剩余固体中回收二氧化锰的方法是溶解、过滤、洗涤和烘干。
(2)夏天温度高,检查装置B的气密性,方法是:连接好仪器,把导管一端放入水中,然后用热毛巾包裹试管或用酒精灯稍加热试管,观察到有气泡冒出,说明装置气密性良好。
(3)实验室常用锌粒和稀硫酸反应生成硫酸锌和氢气的方法来制取氢气,其反应的化学方程式:Zn+H2SO4=ZnSO4+H2↑。
(4)实验室制取二氧化碳,用石灰石和盐酸反应生成氯化钙和水和二氧化碳,化学方程式是CaCO3+2HCl=CaCl2+H2O+CO2↑,发生装置选取A的优点是可以控制反应速率,还可以随时控制反应的开始与停止,设至少需要含80%CaCO3的大理石的质量为x,
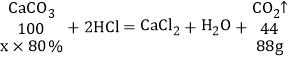
![]()
x=250g
故最少需要含80%CaCO3的大理石250g。
(5)通常状况下,氨气是一种无色、有强烈刺激性气味的污染性气体,极易溶解于水形成氨水,相同条件下密度比空气小,常温下实验室可以用浓氨水与生石灰制取氨气。装置的接口连接顺序是adcf,E装置的作用是吸收氨气防止污染空气。

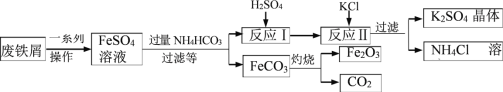
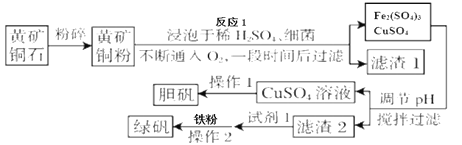
【题目】绿矾被广泛用于医药和工业领域。工业上利用黄铜矿粉(含杂质)主要成分为CuFeS2制取绿矾(FeSO4·7H2O)的流程图如下
(相关资料)
①氢氧化亚铁不稳定,在空气中容易被氧气氧化成氢氧化铁。
②三价铁离子能和金属铁反应,方程式为:Fe2(SO4)3 + Fe = 3FeSO4
③FeSO4易溶于水但不溶于乙醇。
④部分阳离子以氢氧化物形式完全沉淀时溶液的pH见下表。
沉淀物 | 开始沉淀pH | 沉淀完全pH |
Cu(OH)2 | 4.2 | 6.7 |
Fe(OH)2 | 7.6 | 9.7 |
Fe(OH)3 | 1.5 | 2.8 |
(问题解答)
(1)将黄铜矿粉粹的目的是____________。
(2)在调节pH时,为了将滤渣2充分转化为沉淀而析出,需要调节溶液pH的范围为____________。在调节pH时常用铁的氧化物来调节,不选用NaOH溶液进行调节,理由是_______。
(3)最后得到的绿矾晶体用乙醇洗涤,不用水进行洗涤的目的是_______。
(4)黄铜矿粉能够在细菌作用下,与硫酸和氧气发生反应,请写出反应1的化学方程式_______
【题目】下列实验设计不能达到其对应实验目的的是( )
选项 | 实验 | 现象 | 结论 |
A |
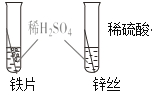
| 铁片表面有少量气泡,锌丝表面有较多气泡 | 说明铁与锌的活泼性 Fe<Zn |
B |
| 硫磺在空气中燃烧发出微弱的淡蓝色火焰,在氧气中发出明亮的蓝紫色火焰 | 说明硫磺在氧气中燃烧更旺盛 |
C |
| ①试管中没有明显现象 ②试管中铁钉生锈 | 说明铁生锈需要水 |
D |
| 试管中白磷燃烧,热水中白磷不燃烧 | 说明燃烧需要氧气 |
A. AB. BC. CD. D
【题目】复方氢氧化镁片[有效成分Mg(OH)2]和复方碳酸镁片[有效成分MgCO3]是两种常见的抗胃酸药。从A或B中任选一个作答,若均作答,按A计分。
A | B |
(1)Mg(OH)2的相对分子质量为___________。 (2)用复方碳酸镁片治疗胃酸过多症时,反应的化学方程式为_____________。 | (1)MgCO3中氧元素质量分数的计算式为___________。 (2)用复方氢氧化镁片治疗胃酸过多症时,反应的化学方程式为__________。 |
【题目】在一支试管中放入一小段镁条(已擦去氧化膜),再向试管中加入一定量的盐酸,镁条表面有________产生,反应的化学方程式是________________________________________________________。
[发现问题]为了再次观察上述反应现象,小林同学用较长的镁条重做上述实验,但发现了异常现象,试管中出现了白色沉淀。
[实验验证1]小林同学针对两次实验的不同,设计对比实验方案,探究出现异常现象的原因。
试管(盛有同体积同浓度的盐酸) | ① | ② | ③ | ④ |
镁条长度 | 1cm | 2cm | 3cm | 4cm |
相同的实验现象(省略题干现象) | 快速反应,试管发热,镁条全部消失 | |||
沉淀量差异(恢复至20℃) | 无 | 少量 | 较多 | 很多 |
[得出结论]镁条与盐酸反应产生白色沉淀与________有关。
[追问]白色沉淀是什么物质?
[查阅资料]①20 ℃时,100 g水中最多能溶解氯化镁54.8 g;
②镁能与热水反应产生一种碱和氢气;
③氯化银既不溶于水也不溶于稀硝酸。
[做出猜想]猜想一:镁;猜想二:氯化镁;猜想三:氢氧化镁,猜想的依据是____________________(用化学方程式表示)。
[实验验证2]将白色沉淀洗涤干净,分别取少量沉淀于A、B、C试管中,进行如表实验:
试管 | 操作 | 现象 | 结论 |
A | 加入足量盐酸 | ________,白色沉淀________ | 猜想一不正确,但这种白色沉淀能溶于盐酸 |
B | 加入足量水 | 白色沉淀________ | 猜想二不正确 |
C | 加入适量稀硝酸 | 白色沉淀消失 | 原白色沉淀中含有的离子是: |
继续滴加几滴硝酸银溶液 | 出现大量白色沉淀 |