题目内容
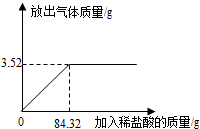 为测定石灰石样品中碳酸钙的质量分数,某学习小组进行了如下实验探究,取10g石灰石样品放入烧杯中,加入稀盐酸至不再产生气泡为止(石灰石中的杂质不溶于水,也不反应),并绘制了加入稀盐酸的质量与放出气体质量的坐标图(见图).
为测定石灰石样品中碳酸钙的质量分数,某学习小组进行了如下实验探究,取10g石灰石样品放入烧杯中,加入稀盐酸至不再产生气泡为止(石灰石中的杂质不溶于水,也不反应),并绘制了加入稀盐酸的质量与放出气体质量的坐标图(见图).
(1)碳酸钙完全反应用去稀盐酸的质量为______g.
(2)该石灰石样品中碳酸钙的质量分数为______.
(3)当盐酸和石灰石恰好完全反应,所得溶液中溶质质量分数是多少?(规范写出计算过程)
解:(1)图象的转折点是二者恰好反应的点,观察图象可知此时用去稀盐酸的质量为84.32g;
(2)据图象可知:该样品最多与盐酸反应生成二氧化碳3.52g;
设碳酸钙的质量为x,生成的氯化钙质量为y
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 111 44
x y 3.52g
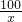 =
=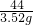 x=8g
x=8g
 =
=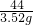 y=8.88g
y=8.88g
该石灰石样品中碳酸钙的质量分数=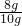 ×100%=80%
×100%=80%
(3)反应后氯化钙溶液的质量为:84.32g+10g-3.52g-(10g-8g)=88.8g
所得溶液中溶质质量分数是: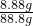 ×100%=10%
×100%=10%
故答案为:(1)84.32;
(2)80%;
(3)所得溶液中溶质的质量分数为10%.
分析:(1)图象的转折点是二者恰好反应的点,观察图象可知此时用去稀盐酸的质量为84.32g;
(2)根据二氧化碳的质量可求出碳酸钙的质量,最后根据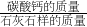 ×100%,可求出石灰石样品中碳酸钙的质量分数;
×100%,可求出石灰石样品中碳酸钙的质量分数;
(3)根据二氧化碳的质量可求出生成的氯化钙的质量,所得溶液的质量=反应前各组份的质量之和-气体的质量-杂质的质量,并据溶质的质量分数解答.
点评:本题是一道关于图象的题目,解答时注意分析图象的起点、转折点和终点及变化趋势,尤其是转折点通常是化学反应恰好完成的点;求反应后所得溶液的质量的质量分数是初中化学计算的一个重点和难点,计算反应后溶液的质量的方法一般是:反应后溶液的质量=反应前各组份的质量之和-气体的质量-沉淀(或杂质)的质量.
(2)据图象可知:该样品最多与盐酸反应生成二氧化碳3.52g;
设碳酸钙的质量为x,生成的氯化钙质量为y
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 111 44
x y 3.52g
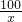 =
=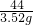 x=8g
x=8g =
=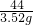 y=8.88g
y=8.88g 该石灰石样品中碳酸钙的质量分数=
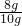 ×100%=80%
×100%=80%(3)反应后氯化钙溶液的质量为:84.32g+10g-3.52g-(10g-8g)=88.8g
所得溶液中溶质质量分数是:
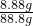 ×100%=10%
×100%=10%故答案为:(1)84.32;
(2)80%;
(3)所得溶液中溶质的质量分数为10%.
分析:(1)图象的转折点是二者恰好反应的点,观察图象可知此时用去稀盐酸的质量为84.32g;
(2)根据二氧化碳的质量可求出碳酸钙的质量,最后根据
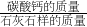 ×100%,可求出石灰石样品中碳酸钙的质量分数;
×100%,可求出石灰石样品中碳酸钙的质量分数;(3)根据二氧化碳的质量可求出生成的氯化钙的质量,所得溶液的质量=反应前各组份的质量之和-气体的质量-杂质的质量,并据溶质的质量分数解答.
点评:本题是一道关于图象的题目,解答时注意分析图象的起点、转折点和终点及变化趋势,尤其是转折点通常是化学反应恰好完成的点;求反应后所得溶液的质量的质量分数是初中化学计算的一个重点和难点,计算反应后溶液的质量的方法一般是:反应后溶液的质量=反应前各组份的质量之和-气体的质量-沉淀(或杂质)的质量.

练习册系列答案
相关题目
 )
)