题目内容
【题目】氢氧燃料电池汽车是一种真正意义上的“零排放,无污染”载运工具,是利用原电池原理,将氢气与氧气通过反应形成电流,并为电动机供电驱动车辆行驶。请回答问题:

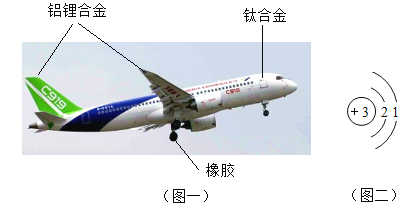
(1)一些汽车车体采用铝合金制成,是因为铝合金与铁合金相比,其在物理性质上具有的优点是______(填字母)。
A 抗腐蚀性好
B 密度小
C 硬度大
(2)氢氧燃料电池汽车在行驶过程中的能量转化过程是________(用“→”表示)。
(3)工业上制取铝通常采用电解法,氧化铝在通电和催化剂条件下分解生成两种单质,请写出电解氧化铝的化学方程式________。
(4)氢氧燃料电池汽车相对于燃油汽车,不仅节约了________还减少了汽车尾气的排放。
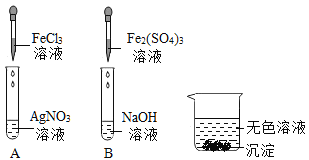
(5)电动汽车中的导线材质都是铜。某兴趣小组同学想从铁和硫酸铜反应后的废液中回收金属铜,设计了如下方案,
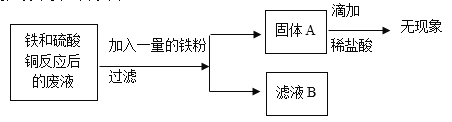
试回答:
①固体A中一定不含________(填化学式)
②滤液B中一定含有的溶质________(填化学式)
【答案】B 化学能→电能→机械能  石油资源 Fe FeSO4
石油资源 Fe FeSO4
【解析】
氧化铝在催化剂通电条件下生成铝和氧气,铁与硫酸铜反应生成的硫酸亚铁和铜。
(1)铝合金与铁合金相比,其在物理性质上具有的优点是密度小,故选B。
(2)氢氧燃料电池汽车在行驶过程中的能量转化过程是化学能先转化为电能,然后再转化为机械能,故氢氧燃料电池汽车在行驶过程中的能量转化过程是化学能→电能→机械能。
(3)氧化铝在催化剂通电条件下生成铝和氧气,反应的化学方程式为 。
。
(4)氢氧燃料电池汽车相对于燃油汽车,不仅节约了石油资源还减少尾气的排放。
(5)①固体A为加入一定量铁粉时,铁与硫酸铜反应生成硫酸亚铁和铜,过滤所得,且加盐酸无现象,故一定不含铁,化学式为Fe。
②铁与硫酸铜反应生成的硫酸亚铁和铜,故滤液B中一定含有的溶质是硫酸亚铁,化学式为FeSO4。