题目内容
【题目】下列是初中化学中常见的物质:碳、铜、氧气、氧化铁、一氧化碳、二氧化碳、水。用它们进行击鼓传球游戏,条件是相互之间能发生反应就可以进行传递,最后一位将球投篮。请把上述物质分别安排在A~G的位置上,使篮球能从A传到G.其中A在常温下是液体,固体B的俗称为干冰。
请回答:
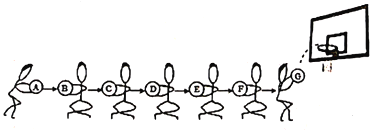
(1)G物质是_____;碳应放在位置_____上。
(2)B和C反应的化学方程式为_____,反应类型为_____反应。
(3)写出A~G传递过程中置换反应的化学方程式_____。
【答案】铜(Cu) C C+CO2![]() 2CO 化合 2Fe2O3+3C
2CO 化合 2Fe2O3+3C![]() 4Fe+3CO2↑
4Fe+3CO2↑
【解析】
A为碳、铜、氧气、氧化铁、一氧化碳、二氧化碳、水中的一种,A在常温下是液体,所以A为水;固体B的俗称为干冰,所以B为二氧化碳;二氧化碳能与碳反应生成一氧化碳,所以C为碳;碳能与氧化铁反应生成铁和二氧化碳,所以D为氧化铁;氧化铁能与一氧化碳反应,所以E为一氧化碳;一氧化碳能与氧气燃烧,所以F为氧气,则G为铜。
(1)由分析可知,G物质为铜,故填铜(Cu);
由分析可知,物质C为碳,故填C。
(2)由分析可知,物质B为二氧化碳,C为碳,二氧化碳与碳在高温的条件下反应生成一氧化碳,故反应的化学方程式写为:C+CO2![]() 2CO;
2CO;
由化学方程式可知,该反应是两种物质反应生成一种物质,反应类型为化合反应,故填化合。
(3)由分析可知,属于置换反应的是物质C与D的反应,即碳与氧化铁在高温的条件下反应生成铁和二氧化碳,故反应的化学方程式写为:2Fe2O3+3C![]() 4Fe+3CO2↑。
4Fe+3CO2↑。

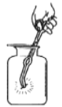
【题目】在学习“燃烧与灭火”的课堂上,老师做了一个有趣的实验:将一根铜丝绕成线圈,罩在蜡烛火焰上(如图所示),观察到火焰立即熄灭。
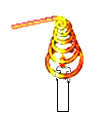
(1)探究一:蜡烛熄灭的原因。
猜想与假设:a.铜线圈隔离了可燃物;b.铜线圈隔绝了空气;c.铜线圈吸热,降温至蜡烛着火点以下。
讨论与交流:经观察分析同学们否定了猜想a和b,理由是___。
设计并进行如下实验:
实验操作 | 实验现象 | 结论 |
将铜圈加热后___ | ___ | 猜想c正确 |
(2)探究二:经过多次上述实验大家发现铜丝表面变黑黑色物质是什么呢?
猜想与假设:①炭黑;②___;③炭黑和氧化铜。
(查阅资料):氧化铜可与稀硫酸反应生成硫酸铜(溶液显蓝色)和水,炭黑不与稀硫酸反应。
讨论交流:铜丝表面产生发炭黑或氧化铜的原因是___(写一条即可)。
实验操作 | 实验现象 | 结论 |
取少许黑色固体至试管中,___ | ___ | 猜想③正确 |
【题目】在学完酸碱盐的知识后,某兴趣小组开展了如下的探究,请回答相关问题。
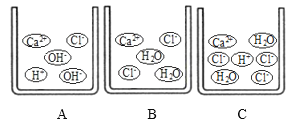
(1)向石灰乳中加入一定量的稀盐酸,得到了澄清溶液,写出发生反应的化学方程式:__________________________。已知氯化钙溶液显中性,现用pH计测得反应后的溶液的pH=4.3,则此时溶液里的粒子示意图正确的是_______(填字母序号)。
(2)已知常温下氢氧化钙的溶解度为 0.17g。若将石灰乳静置一段时间,则得到的上层澄清液体的溶质质量分数为_____(精确到 0.01%)。
(3)向石灰石中加入稀硫酸,发现反应缓慢,如何提高该反应速率呢?
查阅资料:石灰石与稀硫酸反应生成 CaSO4,同时产生CO2气体;且CaSO4 微溶于水。
Ⅰ.甲同学认为可以用增大稀硫酸浓度的方法来提高该反应速率。取相同质量相同规格的石灰石进行了如下实验:
实验 | ①10%硫酸溶液 | ②20%硫酸溶液 | ③40%硫酸溶液 |
观察1分钟内石灰石表面的气泡放出快慢 | 缓慢 | 明显加快 | 开始很快、又迅速变慢 |
由上述实验现象可知,增大稀硫酸的浓度_____(填“一定”或“不一定”)能提高该反应速率。请推测出现实验③中现象的原因:______________________________
Ⅱ.写出另外一种提高该反应速率方法:_____________________________。