题目内容
小明学习了金属活动性顺序后,到实验室进行探究,他将一小块金属钠投入CuSO4溶液中想得到Cu,但却看到亍另外的现象:没有红色物质析出,却生成了大量气体,并出现了蓝色沉淀.小明想到CuSO4溶液中有水,又补做了另一个实验,并记录如下:
| 操 作 步 骤 | 实 验 现 象 |
| ①将一小块钠放入盛水的烧杯中 | 剧烈反应,金属溶解,产生大量气体 |
| ②向反应后的烧杯中滴加酚酞试液 | 酚酞试液变红 |
| ③将产生的气体收集并点燃 | 该气体能燃烧,并产生淡蓝色火焰 |
中呈碱性的物质此处应是________(填“NaOH”或“Na2CO3”),其理由是________;可燃气体是________,其燃烧的化学化学方程式为________.
结论:据上述现象,小明又写出了Na投入CuSO4溶液中另一个产生沉淀的反应的化学方程式:________.
反思:在金属活动性顺序里,位于前面的金属________(填“能”、“不能”或“不一定 能”)把后面的金属从它们化合物的溶液里置换出来.
能 NaOH 化学反应前后元素的种类不变,而水中不含碳元素 氢气 2H2+O2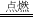 2H2O 2NaOH+CuSO4=Cu(OH)2↓+Na2SO4 能
2H2O 2NaOH+CuSO4=Cu(OH)2↓+Na2SO4 能
分析:【分析】由实验现象产生气体,酚酞试液变红等可知钠能与水反应,并据酚酞遇碱变红,及化学反应前后元素的种类不变分析解答,据反应原理写出方程式;
【结论】根据钠和水反应的生成物有氢氧化钠,及氢氧化钠可与硫酸铜溶液反应生成蓝色沉淀氢氧化铜分析解答;
【结论】了解在金属活动性顺序里,位于前面的金属 能把后面的金属从它们化合物的溶液里置换出来.
解答:【分析】由实验现象产生气体,酚酞试液变红,产生气体能燃烧等可知钠能与水反应;酚酞遇碱变红;根据质量守恒定律可知:化学反应前后元素的种类不变,而水中不含碳元素,所以生成物中呈碱性的物质是氢氧化钠,同时生成可燃性气体氢气;反应方程式2H2+O2 2H2O;
2H2O;
【结论】根据钠和水反应的生成物有氢氧化钠,硫酸铜溶液中含有硫酸铜和水,氢氧化钠可与硫酸铜溶液反应生成蓝色沉淀氢氧化铜.
所以化学方程式是:2NaOH+CuSO4=Cu(OH)2↓+Na2SO4;
【反思】在金属活动性顺序里,位于前面的金属 能把后面的金属从它们化合物的溶液里置换出来.
故答案为:【分析】能;NaOH;化学反应前后元素的种类不变,而水中不含碳元素;氢气;2H2+O2 2H2O;
2H2O;
【结论】2NaOH+CuSO4=Cu(OH)2↓+Na2SO4;
【结论】能.
点评:本考点属于新信息筛选题,主要考查了通过实验现象分析物质的性质,以及质量守恒定律的应用,方程式的书写,能较好考查学生分析、解决问题的能力.
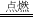 2H2O 2NaOH+CuSO4=Cu(OH)2↓+Na2SO4 能
2H2O 2NaOH+CuSO4=Cu(OH)2↓+Na2SO4 能分析:【分析】由实验现象产生气体,酚酞试液变红等可知钠能与水反应,并据酚酞遇碱变红,及化学反应前后元素的种类不变分析解答,据反应原理写出方程式;
【结论】根据钠和水反应的生成物有氢氧化钠,及氢氧化钠可与硫酸铜溶液反应生成蓝色沉淀氢氧化铜分析解答;
【结论】了解在金属活动性顺序里,位于前面的金属 能把后面的金属从它们化合物的溶液里置换出来.
解答:【分析】由实验现象产生气体,酚酞试液变红,产生气体能燃烧等可知钠能与水反应;酚酞遇碱变红;根据质量守恒定律可知:化学反应前后元素的种类不变,而水中不含碳元素,所以生成物中呈碱性的物质是氢氧化钠,同时生成可燃性气体氢气;反应方程式2H2+O2
 2H2O;
2H2O;【结论】根据钠和水反应的生成物有氢氧化钠,硫酸铜溶液中含有硫酸铜和水,氢氧化钠可与硫酸铜溶液反应生成蓝色沉淀氢氧化铜.
所以化学方程式是:2NaOH+CuSO4=Cu(OH)2↓+Na2SO4;
【反思】在金属活动性顺序里,位于前面的金属 能把后面的金属从它们化合物的溶液里置换出来.
故答案为:【分析】能;NaOH;化学反应前后元素的种类不变,而水中不含碳元素;氢气;2H2+O2
 2H2O;
2H2O;【结论】2NaOH+CuSO4=Cu(OH)2↓+Na2SO4;
【结论】能.
点评:本考点属于新信息筛选题,主要考查了通过实验现象分析物质的性质,以及质量守恒定律的应用,方程式的书写,能较好考查学生分析、解决问题的能力.

练习册系列答案
相关题目
在学习了金属活动性顺序的知识后,小华想在实验室里通过实验验证一下Zn、Fe、Cu三种金属的活动性,设计了如下实验:
①取相同形状的铁片、锌片、铜片,分别用砂纸打磨至光亮,放入试管中。
②分别加入5毫升20%的稀硫酸,观察现象并记录到下面的表格中。
|
试管编号 |
1 |
2 |
3 |
|
反 应 物 |
Zn片+稀H2SO4 |
Fe片+稀H2SO4 |
Cu片+稀H2SO4 |
|
反应现象 |
气泡多、大、上升快 |
气泡细小,上升慢 |
没有气泡 |
(1)根据小华的实验设计可知,他是通过 来判断金属活动性的。
(2)在实验过程中,细心的小华还发现了二个有趣现象①试管发烫,②反应的速度随时间而变化,他粗略的用图像画了下来(如下图)。反应速度为什么会这样变化呢?科学老师给了他一个启示:化学反应的速度跟反应温度、反应物的溶质质量分数有关。经过思考小华给出了一个合理的解释 。

(3)对于验证三种金属的活动性,小明提出了一个 更简单的方案:把锌片、铜片分别放入 溶液,通过观察反应的现象就可以了。
 在学习了金属活动性顺序的知识后,小华想在实验室里通过实验验证一下Zn、Fe、Cu三种金属的活动性,设计了如下实验:
在学习了金属活动性顺序的知识后,小华想在实验室里通过实验验证一下Zn、Fe、Cu三种金属的活动性,设计了如下实验: 内填上相应的内容:常见金属的活动性顺序为
内填上相应的内容:常见金属的活动性顺序为
