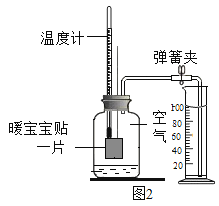
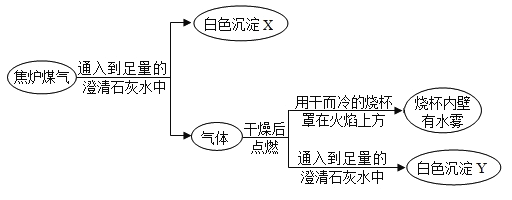
题目内容
【题目】食盐是一种重要的化工原料,请回答下列问题。
(1)请完善实验室除去粗盐中泥沙等难溶性杂质的实验步骤。
![]()
①操作Ⅰ所用的玻璃仪器有:烧杯、玻璃棒和_____。
②在蒸发过程中,待_____时,停止加热,利用余热将滤液蒸干。
(2)由于粗盐中含有少量MgCl2、CaCl2、Na2SO4等杂质,不能满足化工生产的要求,因此必须将粗盐进行精制。流程如下图。
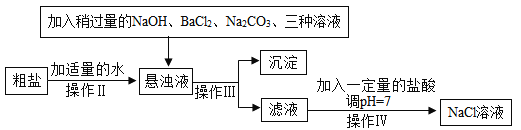
加入稍过量的Na2CO3溶液除了能除去粗盐中的CaCl2外,它还有一个作用是(用化学方程式表示)_____,加入的三种溶液中,_____ 两种溶液可以用_____ 一种溶液替代。
(3)若有溶质质量分数为10%的氯化钠不饱和溶液100 kg,要将其变成20 ℃时氯化钠的饱和溶液,以满足化工生产的需要,可采用的最简便方法是_____(已知:20℃时氯化钠的溶解度为36g)。
【答案】漏斗 蒸发皿中出现较多量晶体 ![]() 氢氧化钠、碳酸钠 碳酸钠 加入22.4kg氯化钠固体
氢氧化钠、碳酸钠 碳酸钠 加入22.4kg氯化钠固体
【解析】
(1①操作Ⅰ为过滤,所用的玻璃仪器有:烧杯、玻璃棒和漏斗。
②在蒸发过程中,待蒸发皿中出现较多量晶体时,停止加热,利用余热将滤液蒸干。
(2)加入稍过量的碳酸钠溶液除了能除去粗盐中的氯化钙外,它还有一个作用是除去反应中过量的氯化钡,碳酸钠与氯化钡反应生成碳酸钡沉淀和氯化钠,用化学方程式表示为![]() ,加入的三种溶液中,氢氧化钠、碳酸钠两种溶液可以用碳酸钠一种溶液替代,因为除去氯化镁也可用碳酸钠,生成的碳酸镁也是沉淀。
,加入的三种溶液中,氢氧化钠、碳酸钠两种溶液可以用碳酸钠一种溶液替代,因为除去氯化镁也可用碳酸钠,生成的碳酸镁也是沉淀。
(3)20℃时氯化钠的溶解度为36g,可以通过加入氯化钠固体的方法是溶液达到饱和状态,设需要加入氯化钠质量为x,则
![]()
x=22.4kg。
故最简便方法是加入22.4kg氯化钠固体。

【题目】用对比实验方法探究二氧化碳的性质。
实验一 |
|
(1)装置l中,将Y形导管平放于桌面上,通入CO2后,观察到a管中试纸_____。通过a、b两管中的实验现象说明CO2的性质是_____(用化学方程式表示)。
(2)装置II中,将Y形管固定在铁架台上,a管在上方,b管在下方,缓缓通入CO2后,通过观察到的现象可说明CO2具有①所验证的性质外,还说明CO2的_____。