题目内容
【题目】请根据常见金属在溶液中的活动性顺序回答。
(1)把金属锰放到硫酸锌溶液中,无明显现象,这说明锰的活动性比锌______;
(2)将铜丝和铁丝分别放入相同浓度的稀![]() 中,依据______现象,证明Fe的活动性比Cu强;
中,依据______现象,证明Fe的活动性比Cu强;
(3)将铜丝放入![]() 溶液中,或向
溶液中,或向![]() 溶液中放入金属______,都能证明Cu的活动性比Ag强,Cu与
溶液中放入金属______,都能证明Cu的活动性比Ag强,Cu与![]() 溶液反应的化学方程式为______。
溶液反应的化学方程式为______。
【答案】弱 只有铁丝表面有气泡 银 ![]()
【解析】
(1)在金属活动性顺序中排在前面的金属可把排在后面的金属从它的盐溶液中置换出来,金属越靠前活动性越强。把金属锰放到硫酸锌溶液中,无明显现象,这说明锰的活动性比锌弱。
(2)将铜丝和铁丝分别放入相同浓度的稀![]() 中,铁能与稀硫酸反应生成氢气,铜不能与稀硫酸反应,所以,依据只有铁丝表面有气泡现象,证明Fe的活动性比Cu强;
中,铁能与稀硫酸反应生成氢气,铜不能与稀硫酸反应,所以,依据只有铁丝表面有气泡现象,证明Fe的活动性比Cu强;
(3)将铜丝放入![]() 溶液中,铜能将银置换出来,向
溶液中,铜能将银置换出来,向![]() 溶液中放入金属银,银不能将铜置换出来,都能证明Cu的活动性比Ag强;Cu与
溶液中放入金属银,银不能将铜置换出来,都能证明Cu的活动性比Ag强;Cu与![]() 溶液反应,生成了银和硝酸铜,反应的方程式是:
溶液反应,生成了银和硝酸铜,反应的方程式是:![]() 。
。

 小学课时特训系列答案
小学课时特训系列答案【题目】某研究小组对过氧化氢溶液制取氧气进行如下探究:
实验一:如图装置可用于多次连续进行氧气的制取和性质的实验。
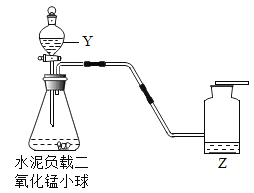
(1)仪器Y的名称是_______。
(2)该反应的化学式表达式:________,二氧化锰在反应中的作用是___。多孔水泥负载二氧化锰小球用于实验时的主要优点是_____,检验氧气已收集满的方法_________。
(3)做氧气的性质实验时,实验不同,Z的作用不同。
①铁丝燃烧。Z为水,其作用是_____。
②蜡烛燃烧。Z为______,其作用是验证蜡烛燃烧生成了二氧化碳。
实验二:探究H2O2质量分数、溶液pH、温度对反应速率的影响
(2)设计如下表实验方案:
实验序号 | H2O2质量分数/% | pH | 温度/℃ | 每分钟气泡数 |
1 | 30 | 5 | 20 | |
2 | 30 | 6 | 20 | |
3 | 30 | 11 | 20 | |
4 | 15 | 11 | 30 | |
5 | a | 11 | b |
①进行实验1~3的目的是探究________。
②a=_________;b=_________。
实验三:探究制取氧气的适宜催化剂

(3)实验方案如下:
I.用MnO2、CuO、Fe2O3、Cr2O3四种催化剂分别与海藻酸钠溶液混合,滴入氯化钙溶液制成含等质量催化剂、大小相同的海藻酸钠微球,备用。
II.取30粒含MnO2的海藻酸钠微球,采用左下图装置进行实验。改用其他三种微球,分别重复上述实验,得到右下图的锥形瓶内压强随时间变化的曲线图。
①每次实验时,海藻酸钠微球数应相同的原因_________。
②用含MnO2的海藻酸钠微球进行实验,60s时压强瞬间回落,其原因是____。
③从实验曲线看,催化效果较好、反应温和的催化剂是______。
【题目】某同学为了测定实验室中氯酸钾样品的纯度。取2.5克该样品与0.5克二氧化锰混合,加热一段时间后(杂质不参加反应),冷却,称量剩余物质量,重复上述操作,记录数据如下表:
加热时间 | T1 | T2 | T3 | T4 |
剩余物质量 | 2.12 | 2.08 | 2.04 | 2.04 |
①加热到T2时间后,氯酸钾是否已经反应完全?_____
②样品中氯酸钾的质量分数_______