题目内容
【题目】经过一年的学习,我们对“酸碱盐”有了一定的认识,请回答下列有关问题.
(1)下列说法中不正确的是 .
A.酸和碱中一定都含有氢元素
B.氯化钠由氯化钠离子构成
C.多数酸和碱都有腐蚀性
D.浓硫酸可用作某些气体的干燥剂
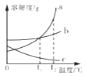
(2)在用稀盐酸和氢氧化钠溶液进行中和反应的实验时,反应过程中溶液的酸碱度变化如图所示,该图横坐标代表的是溶液的质量.当加入该溶液的质量为ag时,所得溶液中含量最多的溶质为(写化学式) . 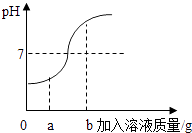
(3)某敞口放置的氢氧化钠溶液已经变质,请用化学方程式表示其变质的原因.
(4)为了证明该瓶氢氧化钠溶液未完全变质,进行了以下实验,请将如表填写完整.
实验操作 | 现象 | 结论或化学方程式 |
取少量该样品,滴加足量的 | 有白色沉淀生成 | 方程式为: |
在滤液中滴加酚酞溶液 | 样品未完全变质 |
(5)现有部分变质的氢氧化钠样品18.6g与146g溶质质量分数为10%的盐酸溶液恰好完全反应生成CO24.4g,计算样品中NaOH的质量分数?
【答案】
(1)B
(2)NaOH;NaCl
(3)2NaOH+CO2=Na2CO3+H2O
(4)BaCl2;Na2CO3+BaCl2=BaCO3↓+2NaCl;滤液显红色
(5)解:设参加反应的碳酸钠的质量为x
Na2CO3+2HCl=2NaCl+H2O+ | CO2↑ |
106 | 44 |
x | 4.4g |
![]() =
= ![]()
x=10.6g
所以样品中NaOH的质量分数为: ![]() ×100%=43%.
×100%=43%.
答:样品中NaOH的质量分数为43%
【解析】解:(1)A、酸在水溶液中会电离出氢离子,碱在水溶液中会电离出氢氧根离子,所以酸和碱中一定都含有氢元素,故A正确; B、氯化钠由钠离子、氯离子构成的,故B错误;
C、多数酸和碱都有腐蚀性,故C正确;
D、浓硫酸具有吸水性,故D正确;
故选:B;(2)由图象中pH值的变化情况可知,开始溶液的pH值小于,然后随着另一种溶液的加入,溶液的pH值逐渐的增大到7,然后大于7,所以该图横坐标代表的是NaOH溶液的质量,当加入该溶液的质量为ag时,所得溶液中含量最多的溶质为NaCl;(3)氢氧化钠和二氧化碳反应生成碳酸钠和水,化学方程式为:2NaOH+CO2=Na2CO3+H2O;(4)检验碳酸钠的变质情况,先加氯化钡或氯化钙检验是否含有碳酸钠,然后加酚酞检验是否含有氢氧化钠,所以
实验操作 | 现象 | 结论或化学方程式 |
取少量该样品,滴加足量的BaCl2溶液,过滤 | 有白色沉淀生成 | 方程式为:Na2CO3+BaCl2=BaCO3↓+2NaCl |
在滤液中滴加酚酞溶液 | 滤液显红色 | 样品未完全变质 |
所以答案是:(1)B;(2)NaOH,NaCl;(3)2NaOH+CO2=Na2CO3+H2O;(4)BaCl2(或CaCl2),Na2CO3+BaCl2=BaCO3↓+2NaCl,滤液显红色;(5)43%.
【考点精析】本题主要考查了中和反应及其应用和根据化学反应方程式的计算的相关知识点,需要掌握中和反应:酸与碱作用生成盐和水的反应;各物质间质量比=系数×相对分子质量之比才能正确解答此题.

 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案