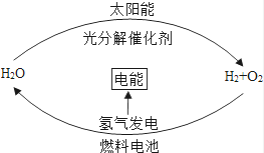
��Ŀ����
����Ŀ��ʳ��С�մ���NaHCO3���������NaCl��Ϊ�˲ⶨijʳ��С�մ���NaHCO3������������ijͬѧ��������ʵ�飺��ȡһ��������Ʒ���ձ��У���ˮʹ����ȫ�ܽ⣬�õ�104.4g��Һ���������еμ�100gϡ���ᣬǡ����ȫ��Ӧʱ�õ�200g������������3.1%�IJ�������Һ������Ӧ�Ļ�ѧ����ʽΪ��NaHCO3+HCl===NaCl+H2O+CO2����
����㣺
��1��NaHCO3��̼����Ԫ�ص�������Ϊ________��
��2������CO2������Ϊ_________g��
��3����ʳ��С�մ���NaHCO3����������________��д��������̣���
���𰸡�1��4��4.4g��96%��
��������
���������غ㶨�ɿ�֪����Ӧ�����������ļ�������Ϊ�����˶�����̼���������������̼�����������ݶ�����̼�������Ͷ�Ӧ�Ļ�ѧ����ʽ�����ʳ��С�մ��� NaHCO3������������
��1��NaHCO3��̼����Ԫ�ص�������Ϊ12����16��3��=1��4��
��2�����������غ㶨�ɿɵã����ɵĶ�����̼������Ϊ104.4g+100g��200g=4.4g��
��3���裺��ʳ��С�մ��� NaHCO3������Ϊx�����ɵ��Ȼ��Ƶ�����Ϊy��
NaHCO3+HCl�TNaCl+H2O+CO2��
84 58.5 44
x y 4.4g
![]() x=8.4g
x=8.4g
![]() y=5.85g
y=5.85g
���ʳ��С�մ��� NaHCO3����������Ϊ![]() ��100%=96%
��100%=96%
�𣺣�1��NaHCO3��̼����Ԫ�ص�������Ϊ 1��4��
��2������CO2������Ϊ 4.4g��
��3����ʳ��С�մ��� NaHCO3����������Ϊ96%��