题目内容
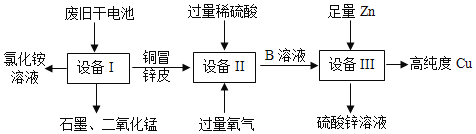
【题目】CaCl2 应用广泛,以石灰石(杂质主要是 Fe2O3、MgSO4)为原料生产 CaCl2 的流程如下:
![]()
(1)氧化铁和盐酸反应的化学方程式为___。
(2)过滤操作中用到的玻璃仪器有烧杯、玻璃棒和___。
(3)滤液 1 中的溶质有 HCl、FeCl3、MgSO4 和___。
(4)写出滤液 1 中加入 BaCl2 发生的化学反应方程式___。
(5)滤液 2 中加入 Ca(OH)2 可以除去 HCl、MgCl2 和___。
(6)滤液 3 呈碱性,为使溶液 pH 降低,可加入适量的___。
【答案】Fe2O3+6HCl=2FeCl3+3H2O漏斗CaCl2BaCl2+MgSO4=BaSO4↓+MgCl2FeCl3HCl
【解析】
(1)氧化铁和盐酸反应生成氯化铁和水,化学方程式为:Fe2O3+6HCl=2FeCl3+3H2O;
(2)过滤操作中用到的玻璃仪器有烧杯、玻璃棒和漏斗;
(3)盐酸和碳酸钙反应生成氯化钙、水和二氧化碳,所以所以滤液1中的溶质有HCl、FeCl3、MgSO4和CaCl2;
(4)氯化钡和硫酸镁反应生成硫酸钡沉淀和氯化镁,化学方程式为:BaCl2+MgSO4=BaSO4↓+MgCl2;
(5)氯化镁、氯化铁、盐酸对于氯化钙来说,也是杂质,都会与氢氧化钙反应生成氯化钙,滤液2中加入Ca(OH)2可以除去HCl、MgCl2和 FeCl3 ;
(6)石灰乳足量,所以过滤后的溶液中含有氢氧化钙,所以加入的试剂X是盐酸,盐酸和氢氧化钙反应生成氯化钙和水,所以滤液3呈碱性,为使溶液pH降低,可加入适量的HCl。

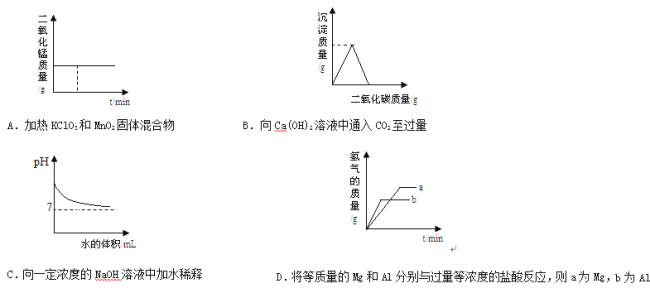
【题目】下列实验的现象或结论不正确的一组是
选项 | A | B | C | D |
实验 |
|
|
|
|
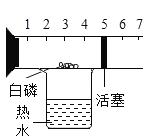
实验现象 | 打开汽水瓶盖时,汽水会自动喷出来 | 硫在空气中燃烧发出微弱的淡蓝色火 焰,硫在氧气中燃 烧发出明亮的蓝紫 色火焰 | 白磷燃烧产生大量烟,活塞先向右 再向左移动,冷却 至室温后,最终停 在刻度“4”附近 | 装铁丝的试管中有气泡产生,装铜丝 的试管中无明显现 象 |
实验结论 | 说明气体在水中的溶解度随压强的增 大而减小 | 说明氧气的浓度是影响硫燃烧剧烈程 度的因素 | 氧气约占空气体积的五分之一 | 说明铁与铜的活泼性 Fe>Cu |
A. A B. B C. C D. D
【题目】学习盐酸的化学性质后,小娟做如下实验:
(实验探究)
实验步骤 | 实验操作 | 实验现象 | 结论或解释 |
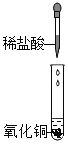
Ⅰ |
| 黑色固体完全溶解,溶液呈_____色 | 盐酸与氧化铜发生了化学反应 |
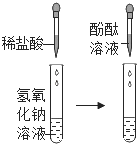
Ⅱ |
| 加入稀盐酸后,未观察到明显现象;滴入酚酞后,溶液变红色 | 盐酸与氢氧化钠未发生化学反应 |
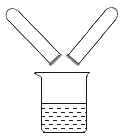
Ⅲ |
将步骤Ⅰ、Ⅱ的废液混合 | 有沉淀生成,溶液仍为红色 | 生成沉淀的原因(用化学方程式解释)_____;所得溶液中溶质的成分_____(酚酞除外) |
(实验反思)
小勇认为小娟实验步骤Ⅱ的结论不正确,理由是_____,于是小娟另取试管重新做了步骤Ⅱ的实验,在滴入酚酞溶液变红色后,继续滴加稀盐酸。边滴边振荡。当观察到_____时,说明盐酸与氢氧化钠发生了反应。从微观角度看,此反应的实质是_____。
实验结束后,小娟将步骤Ⅲ烧杯中的溶液进行了过滤,并向所得溶液中加入_____再倒掉,以防止环境污染。
【题目】某化学兴趣小组设计了如下实验来探究影响锌与稀硫酸反应速率的因素(实验过程中杂质不能与稀硫酸反应),实验数据记录如下表:
实验编号 | 试剂 | 产生50mL氢气 的时间/s | ||
不同纯度的锌 | 稀硫酸的浓度 | 稀硫酸的用量/ mL | ||
a | 纯锌 | 30% | 30 | 52 |
b | 含杂质的锌 | 30% | 30 | 47 |
c | 纯锌 | 20% | 30 | 68 |
d | 纯锌 | 30% | 40 | 50 |
(1)实验_____和实验______(填实验编号)的实验目的是为了研究硫酸浓度对反应速率的影响。
(2)对比实验a和实验b,可以得到的实验结论是____________________。
(3)计算9.8g纯硫酸与足量的锌完全反应,可制得氢气是_________克?请你帮他们完善计算过程:
①______________②____________________