题目内容
某化学实验小组实验结束时,将含有CuSO4、ZnSO4、FeSO4的废液倒在废液缸里,为回收有关金属和盐,同学们设计了如图1实验方案:
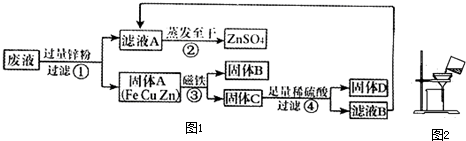
试回答:
(1)步骤①中锌粉必须过量的原因是______;
(2)写出步骤①中任一反应的化学方程式______;
(3)检验步骤④中加入的稀硫酸是否足量的方法是______;
(4)指出如图2的过滤操作的错误______;在蒸发滤液A的过程中,用玻璃棒不断搅拌的作用______;
(5)若实验过程中的物质损失忽略,最终所得硫酸锌的质量______(填“大于”、“小于”或“等于”)原废液中硫酸锌的质量.要计算该废液中硫酸铜质量,必须要称量______的质量.
解:(1)步骤①中锌粉必须过量的原因是:将废液中的Cu2+和Fe2+全部置换出来.
故填:将废液中的Cu2+和Fe2+全部置换出来.
(2)锌和硫酸铜反应能生成硫酸锌和铜,锌和硫酸亚铁反应能生成硫酸锌和铁,反应的化学方程式分别为:Zn+CuSO4=ZnSO4+Cu、Zn+FeSO4═ZnSO4+Fe.
故填:Zn+CuSO4=ZnSO4+Cu或Zn+FeSO4═ZnSO4+Fe.
(3)检验步骤④中加入的稀硫酸是否足量的方法是:继续加入少量稀硫酸,观察是否有气泡产生,如果没有气泡产生,说明稀硫酸足量.
故填:继续加入少量稀硫酸,观察是否有气泡产生.
(4)如图2过滤操作中的错误有:没用玻璃棒引流、滤纸边缘高于漏斗口.
故填:没用玻璃棒引流、滤纸边缘高于漏斗口.
在蒸发滤液A的过程中,用玻璃棒不断搅拌的作用是使液体均匀受热,防止飞溅.
故填:使液体均匀受热,防止飞溅.
(5)若实验过程中的物质损失忽略,最终所得硫酸锌的质量大于原废液中硫酸锌的质量.
故填:大于.
要计算该废液中硫酸铜质量,必须要称量固体D的质量,固体D是铜.
故填:固体D或铜.
分析:(1)锌比铜、铁活泼,能够把铁离子、铜离子从溶液中置换出来;
(2)根据反应物、生成物及其质量守恒定律可以书写化学方程式;
(3)锌和稀硫酸反应能生成氢气;
(4)过滤时要注意一贴、二低、三靠.一贴是指滤纸紧贴漏斗内壁.二低是指滤纸低于漏斗边缘,液面低于滤纸边缘.三靠是指上面的烧杯紧靠玻璃棒,玻璃棒紧靠三层滤纸一面,漏斗末端紧靠烧杯内壁;
(5)因为①中加入了锌粉,若实验过程中的物质损失忽略,最终所得硫酸锌的质量应该大于原废液中硫酸锌的质量,要计算该废液中硫酸铜质量,必须要称量铜的质量.
点评:化学实验现象是化学实验最突出、最鲜明的部分,也是进行分析推理得出结论的依据,掌握物质的性质和相互之间的反应关系,并有助于提高观察、实验能力.所以,对化学实验不仅要认真观察,还应掌握设计实验、观察实验现象的方法.
故填:将废液中的Cu2+和Fe2+全部置换出来.
(2)锌和硫酸铜反应能生成硫酸锌和铜,锌和硫酸亚铁反应能生成硫酸锌和铁,反应的化学方程式分别为:Zn+CuSO4=ZnSO4+Cu、Zn+FeSO4═ZnSO4+Fe.
故填:Zn+CuSO4=ZnSO4+Cu或Zn+FeSO4═ZnSO4+Fe.
(3)检验步骤④中加入的稀硫酸是否足量的方法是:继续加入少量稀硫酸,观察是否有气泡产生,如果没有气泡产生,说明稀硫酸足量.
故填:继续加入少量稀硫酸,观察是否有气泡产生.
(4)如图2过滤操作中的错误有:没用玻璃棒引流、滤纸边缘高于漏斗口.
故填:没用玻璃棒引流、滤纸边缘高于漏斗口.
在蒸发滤液A的过程中,用玻璃棒不断搅拌的作用是使液体均匀受热,防止飞溅.
故填:使液体均匀受热,防止飞溅.
(5)若实验过程中的物质损失忽略,最终所得硫酸锌的质量大于原废液中硫酸锌的质量.
故填:大于.
要计算该废液中硫酸铜质量,必须要称量固体D的质量,固体D是铜.
故填:固体D或铜.
分析:(1)锌比铜、铁活泼,能够把铁离子、铜离子从溶液中置换出来;
(2)根据反应物、生成物及其质量守恒定律可以书写化学方程式;
(3)锌和稀硫酸反应能生成氢气;
(4)过滤时要注意一贴、二低、三靠.一贴是指滤纸紧贴漏斗内壁.二低是指滤纸低于漏斗边缘,液面低于滤纸边缘.三靠是指上面的烧杯紧靠玻璃棒,玻璃棒紧靠三层滤纸一面,漏斗末端紧靠烧杯内壁;
(5)因为①中加入了锌粉,若实验过程中的物质损失忽略,最终所得硫酸锌的质量应该大于原废液中硫酸锌的质量,要计算该废液中硫酸铜质量,必须要称量铜的质量.
点评:化学实验现象是化学实验最突出、最鲜明的部分,也是进行分析推理得出结论的依据,掌握物质的性质和相互之间的反应关系,并有助于提高观察、实验能力.所以,对化学实验不仅要认真观察,还应掌握设计实验、观察实验现象的方法.

练习册系列答案
相关题目
 碳酸氢钠(NaHCO3)俗称小苏打,常用于食品和医药工业.某化学兴趣小组的同学对碳酸氢钠的性质进行探究.
碳酸氢钠(NaHCO3)俗称小苏打,常用于食品和医药工业.某化学兴趣小组的同学对碳酸氢钠的性质进行探究.
实验一:探究碳酸氢钠溶液的酸碱性
取碳酸氢钠溶液少许,滴加无色酚酞溶液变红,由此可知碳酸氢钠溶液呈______性.
实验二:探究碳酸氢钠的热稳定性
[查阅资料]碳酸氢钠受热容易分解,生成水、二氧化碳气体和一种常见的固体物质.
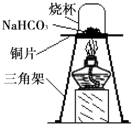
[进行实验]为验证碳酸氢钠受热时会分解,兴趣小组的同学取一定质量的碳酸氢钠到铜片上加热,如图所示.
(1)加热一段时间后,观察到烧杯内壁有______生成.
(2)充分加热后,将烧杯迅速倒转过来,倒入适量的澄清石灰水,振荡,观察到石灰水变浑浊.写出该反应的化学方程式:______.
(3)兴趣小组的同学认为充分加热后的固体产物可能是NaOH或Na2CO3.
①兴趣小组的同学猜想的依据是______.
②请设计实验检验反应后的固体产物是NaOH还Na2CO3,并填入下表:
| 实 验 操 作 | 预期实验现象 | 结 论 |
| 取少量固体产物,向其中加入______. | 有气泡产生 | 固体产物是Na2CO3,而不是NaOH. |
 某化学兴趣小组的同学发现:发酵粉能够使面团松软、发泡是因为发酵粉产生了CO2所致.发酵粉的主要成分中有碳酸氢钠(NaHCO3),俗称小苏打,他们对碳酸氢钠的性质进行了探究.
某化学兴趣小组的同学发现:发酵粉能够使面团松软、发泡是因为发酵粉产生了CO2所致.发酵粉的主要成分中有碳酸氢钠(NaHCO3),俗称小苏打,他们对碳酸氢钠的性质进行了探究. 化学实验中常常会出现意外情况,这是提升我们学科素养的良好机会,要根据具体情况区别对待,善于发现和解决问题.例如:
化学实验中常常会出现意外情况,这是提升我们学科素养的良好机会,要根据具体情况区别对待,善于发现和解决问题.例如: