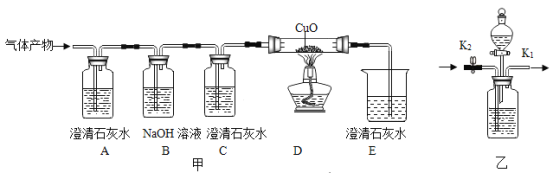
题目内容
【题目】1.6g某物质在氧气中完全燃烧生成4.4g二氧化碳和3.6g水,关于该物质的组成有下列论断,其中正确的是( )
①一定含C、H;②一定不含O;③可能含O;④一定含O;⑤分子中C、H的原子个数比为1:2;⑥分子中C、H的原子个数比为1:4.
A. ①②⑤B. ①②⑥C. ①③⑥D. ①④⑤
【答案】B
【解析】
化学反应遵循质量守恒定律,即反应前后元素种类不变,原子的种类、个数不变。
1.6g某物质在氧气中完全燃烧生成4.4g二氧化碳和3.6g水,,则参加反应的氧气的质量为:4.4g+3.6g1.6g=6.4g;4.4g二氧化碳中碳元素的质量为:4.4g×![]() ×100%=1.2g,氧元素的质量为:4.4g1.2g=3.2g,由于生成物中氧元素质量与参加反应的氧气中氧元素质量相等,故该物质中一定不含氧元素;3.6g水中氢元素的质量为:3.6g×
×100%=1.2g,氧元素的质量为:4.4g1.2g=3.2g,由于生成物中氧元素质量与参加反应的氧气中氧元素质量相等,故该物质中一定不含氧元素;3.6g水中氢元素的质量为:3.6g×![]() ×100%=0.4g;氧元素的质量为:3.6g0.4g=3.2g;分子中C、H的原子个数比为:
×100%=0.4g;氧元素的质量为:3.6g0.4g=3.2g;分子中C、H的原子个数比为:![]() :
:![]() =1:4,故选B。
=1:4,故选B。

【题目】某化学课堂围绕“酸碱中和反应”,将学生分成若干小组,在老师引导下开展探究活动.以下是教学片段,请你参与学习并帮助填写空格(包括表中空格).
(演示实验)将一定量的稀H2SO4加入到盛有NaOH溶液的烧杯中.
(学生板演)该反应的化学方程式_____.
Ⅰ.定性探究
(提出问题)实验中未观察到明显现象,部分同学产生了疑问:反应后溶液中溶质是什么呢?
(猜想)针对疑问大家纷纷提出猜想.甲组同学的猜想如下:
猜想一:只有Na2SO4 猜想二:有Na2SO4和H2SO4
猜想三:有Na2SO4和NaOH 猜想四:有Na2SO4、H2SO4和NaOH
乙组同学对以上猜想提出质疑,认为有一种猜想是不合理的.你认为不合理的猜想是哪一种并说出理由_____.
(继续实验)(1)丙组同学取烧杯中的少量溶液于试管中,滴加几滴CuSO4溶液,无明显变化,溶液中一定没有_____.
(2)为了验证其余猜想,各组同学取烧杯中的溶液,并选用老师提供的pH试纸、铜片、BaC12溶液、Na2CO3溶液,分别进行如表三组探究实验.
实验方案 | ①测溶液pH | ②滴加Na2CO3溶液 | ③滴加BaCl2溶液 |
实验操作 |
|
|
|
实验现象 | 试纸变色,与标准比色卡比照,得pH<7 | _____ | 产生白色沉淀 |
实验结论 | 溶液中有H2SO4 | 溶液中有H2SO4 | 溶液中有H2SO4 |
(得出结论)通过探究,全班同学一致确定猜想二是正确的.
(评价反思)老师对同学们能用多种方法进行探究,并且得出正确结论给予了肯定.同时也指出上述三个实验探究中存在两处明显错误,请大家反思.同学们经过反思发现了这两处错误:
(1)实验操作中明显的一处错误是_____;
(2)实验方案探究中也有一个是不合理的,这个方案是_____(选填①、②、③),不合理的原因是_____.
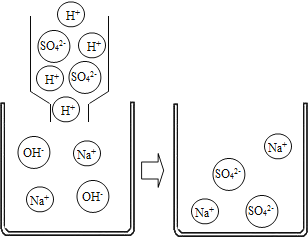
(剖析本质)实验后,老师又带领大家从微观的角度来理解此反应的实质,请你和同学们一起在如图反应后的方框中补画未画全的微粒____.
II.定量探究
取上述(演示实验)反应后烧杯中的溶液100g,设计如图实验:

试计算上述(演示实验)反应后溶液中Na2SO4的质量分数是___________?(列出计算过程)
【题目】某化学小组进行了如下实验探究。
(提出问题)溶液中复分解反应的实质是什么?
(查阅资料)
①电导率传感器用于测量溶液的导电性强弱,能反应离子浓度大小。
②相同温度下同种溶液电导率越大,离子浓度越大。
(实验一)测定四种溶液的电导率
室温下,分别取20mL下列液体于烧杯中,插入电导率传感器如图1,测得数据如下表:(烧杯中的物质静置于空气中备用)

物质 | ①蒸馏水 | ②稀硫酸 | ③氢氧化钠溶液 | ④硫酸钡悬浊液 |
电导率/(μS/cm) | 3 | 5923 | 6316 | 3 |
(1)测出物质①④与物质②③的电导率数据差异巨大的原因是_________。
(实验二)测定氢氧化钡与稀硫酸反应过程中的电导率
室温下,将上述烧杯中的氢氧化钡溶液倒出10mL于另一烧杯中,向其中滴加2-3滴无色酚酞试液,插入电导率传感器,然后滴加稀硫酸,测得溶液的电导率变化如图2中甲曲线所示。
(2)写出氢氧化钡与硫酸反应的化学方程式:___________。
(3)M点时电导率几乎为零的原因是__________.
(4)通过对甲曲线的分析,下列说法错误的是_______(填字母序号)。
A M点前曲线下滑的过程中,H+和OH-结合成H2O,Ba2+和SO42-结合成BaSO4
B M点后溶液电导率逐渐增大,是由于BaSO4进一步解离出Ba2+和SO42-
(实验三)测定氢氧化钡与硫酸钠反应过程中的电导率
室温下,将实验二中稀硫酸改为硫酸钠溶液,重复上述实验,测得溶液的电导率变化如图2中乙曲线所示。
(5)写出硫酸钠与氢氧化钡反应的化学方程式____________。
(6)对比两曲线的最低点,N点比M点明显高的原因是_____,P点时溶液中大量含有的离子是_____(填离子符号)。
(结论)
(7)通过比较分析,结合已学知识可知,溶液中复分解反应的实质是参与反应的离子结合生成了沉淀、气体或水,导致其浓度_______(填“增大”或“减小”)。
(拓展与反思)
(8)向一定量饱和澄清石灰水中持续通入过量的二氧化碳气体,溶液先变浑浊后浑浊逐渐消失。推测此过程的溶液中Ca2+的浓度变化情况是____________。
(9)实验二中刚开始时,氢氧化钡溶液的电导率小于实验一中测得的6316μS/cm,原因可能是________。
(10)若用实验一中物质②与③反应来测定电导率随时间的变化情况,你推测溶液的变化曲线可能是_____________(填“甲”或“乙”)。