题目内容
人类的生产生活离不开金属.
(1)金属铁、铝常用来制作炊具,主要是利用其 性.
(2)人类每年从自然界提取大量的金属,其中提取量最大的是铁.赤铁矿(主要成分为Fe2O3)和一氧化碳炼铁的化学方程式为 .
(3)我国钢铁年产量很高,但因锈蚀造成的损失也很惊人.工业上常用稀盐酸除去铁锈,该反应的化学方程式为 .
(4)从含有CuSO4、ZnSO4、FeSO4的废水中回收重要原料硫酸锌和有关金属,实验过程如下.

请回答:
写出步骤①中发生反应的化学方程式 ; ;固体D的化学式为 ;以上物质A~G中,含有锌元素的是 (填字母序号)
| (1)根据金属性质的应用解答;(2)根据金属铁的冶炼原理方程式解答;(3)根据方程式的书写考虑;(4)根据题中的信息,推导出反应物和生产物,正确书写化学方程式.根据加入的过量锌与硫酸铜和硫酸亚铁反应,得到的固体B中含有铁、铜、锌,再利用磁铁分离开铁,再利用硫酸把铜和锌分开,再进一步进行分析即可. | |
| 解答: | 解:(1)作炊具,主要是利用金属的导热性. (2)用赤铁矿(主要成分为Fe2O3)和一氧化碳炼铁的反应物是一氧化碳和氧化铁,写在等号的左边,生成物铁和二氧化碳写在等号的右边,根据得失氧进行配平,反应条件是高温写在等号的上边,所以化学方程式为:3CO+Fe2O3 (3)盐酸除铁锈的反应物是盐酸和氧化铁写在等号的左边,生成物氯化铁和水写在等号的右边,用观察法配平即可,所以方程式是:6HCl+Fe2O3=2FeCl3+3H2O. (4)根过量A是加入的锌,锌与硫酸亚铁反应生成铁和硫酸锌,所以方程式是:Zn+FeSO4═Fe+ZnSO4;锌与硫酸铜反应生成铜和硫酸锌,所以方程式是:Zn+CuSO4═ZnSO4+Cu;由于锌与硫酸亚铁反应生成铁盒硫酸锌,锌与硫酸铜反应生成铜和硫酸锌,且加入的锌是过量的,所以固体B中含有锌、铁、铜;溶液C是硫酸锌溶液;固体B用磁铁把铁吸引出来,所以固体D是铁;固体E中含有锌和铜,由于锌能与硫酸反应,铜与硫酸不反应,所以加入的溶液F是稀硫酸,溶液G是硫酸锌溶液;所以含有锌元素的有ABCEG. 故答案为:(1)导热性; (2)3CO+Fe2O3 |

 名校课堂系列答案
名校课堂系列答案 2Fe+3CO2.
2Fe+3CO2. 2Fe+3CO2;(3)6HCl+Fe2O3=2FeCl3+3H2O;(4)Zn+FeSO4=Fe+ZnSO4 ;Zn+CuSO4=ZnSO4+Cu;Fe;ABCEG.
2Fe+3CO2;(3)6HCl+Fe2O3=2FeCl3+3H2O;(4)Zn+FeSO4=Fe+ZnSO4 ;Zn+CuSO4=ZnSO4+Cu;Fe;ABCEG.
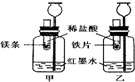 人类的生产生活离不开金属.(1)在地壳里含量居第二位的金属元素是
人类的生产生活离不开金属.(1)在地壳里含量居第二位的金属元素是
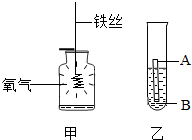 人类的生产生活离不开金属,下列三种金属被发现、使用的先后顺序依次为:铜、铁、铝.
人类的生产生活离不开金属,下列三种金属被发现、使用的先后顺序依次为:铜、铁、铝.