题目内容
取一定质量的CO和CO2的混合气体,通入到足量的Ba(OH)2溶液中,充分反应后过滤,测得生成的沉淀和所取的混合气体的总质量相等.则原混合气体中碳原子和氧原子的个数比为( )A.1:1
B.2:3
C.153:28
D.181:209
【答案】分析:混合气体中只有CO2与Ba(OH)2反应可生成碳酸钡沉淀,用假设法假设二氧化碳的质量,利用反应的化学方程式,计算出CO2和CO的质量和为197克,进而求出CO质量;然后再根据物质的量与物质质量的关系求出二氧化碳和一氧化碳中碳的量,进而求出混合气体中碳原子和氧原子的总量,再进行比较即可.
解答:解:设CO2的质量为44克,根据化学方程式CO2+Ba(OH)2=BaCO3↓+H2O,解得BaCO3质量为197克,即CO2和CO质量和为197克,故CO质量为197g-44g=153克;
n(CO2)= =
= =1mol,
=1mol,
所以CO2中n(C)=1mol,n(O)=2mol;
n(CO)= =
= =
= mol,
mol,
所以CO中n(C)= mol,n(O)=
mol,n(O)= mol;
mol;
所以混合气体中碳原子和氧原子的个数比=n(C)总:n(O)总=(1mol+ mol):(2mol+
mol):(2mol+ mol)=181:209.
mol)=181:209.
故选D.
点评:本题运用假设法计算出混合气体中CO和CO2的质量,再根据物质的量进行计算,对初中学生来说比较困难.
解答:解:设CO2的质量为44克,根据化学方程式CO2+Ba(OH)2=BaCO3↓+H2O,解得BaCO3质量为197克,即CO2和CO质量和为197克,故CO质量为197g-44g=153克;
n(CO2)=
 =
= =1mol,
=1mol,所以CO2中n(C)=1mol,n(O)=2mol;
n(CO)=
 =
= =
= mol,
mol,所以CO中n(C)=
 mol,n(O)=
mol,n(O)= mol;
mol;所以混合气体中碳原子和氧原子的个数比=n(C)总:n(O)总=(1mol+
 mol):(2mol+
mol):(2mol+ mol)=181:209.
mol)=181:209.故选D.
点评:本题运用假设法计算出混合气体中CO和CO2的质量,再根据物质的量进行计算,对初中学生来说比较困难.

练习册系列答案
 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案
相关题目
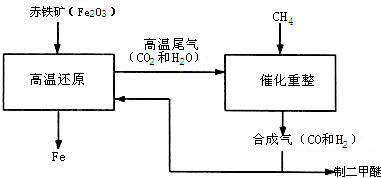
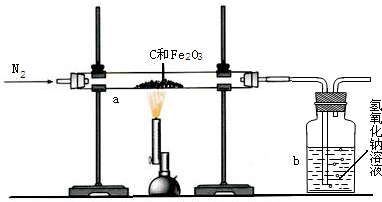
 某研究性学习小组设计并进行了如下实验.
某研究性学习小组设计并进行了如下实验.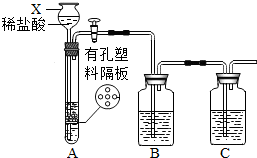 某研究性学习小组设计并进行了如下实验.
某研究性学习小组设计并进行了如下实验.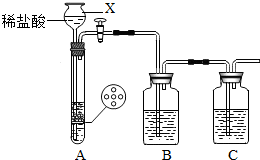 (2012?崇川区一模)某研究性学习小组设计并进行了如下实验.
(2012?崇川区一模)某研究性学习小组设计并进行了如下实验. 某研究性学习小组设计并进行了如下实验.
某研究性学习小组设计并进行了如下实验.