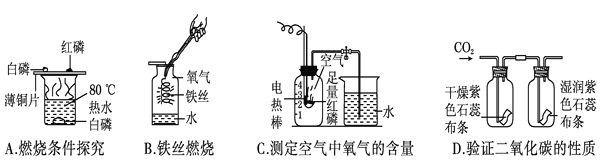
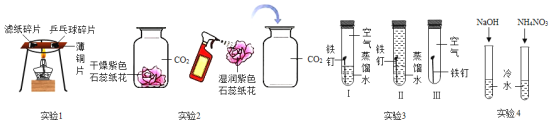
题目内容
【题目】请用化学方程式表示下列反应原理
(1)向充满二氧化碳的集气瓶中加入紫色石蕊溶液,振荡后,观察到溶液变红______________。
(2)天然气用作燃料________________。
(3)铝制品耐腐蚀的原因___________________。
【答案】H2O+CO2=H2CO3 CH4+2O2![]() CO2+2H2O 4Al+3O2═2Al2O3
CO2+2H2O 4Al+3O2═2Al2O3
【解析】
(1)二氧化碳与水反应生成碳酸,碳酸能使紫色的石蕊试液变红色,反应的化学方程式为:H2O+CO2=H2CO3;
(2)天然气的主要成分是甲烷,甲烷与氧气在点燃的条件下反应生成二氧化碳和水,反应的化学方程式为:CH4+2O2![]() CO2+2H2O;
CO2+2H2O;
(3)铝制品耐腐蚀,是因为铝与空气中的氧气反应生成一层致密的氧化铝薄膜,反应的化学方程式为4Al+3O2═2Al2O3。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】某小组同学设计并进行实验,探究影响过氧化氢分解速率的因素。(实验装置如图所示,夹持仪器已略去)
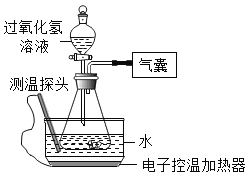
(猜想与假设)
影响过氧化氢分解速率的因素可能有温度、溶液的浓度、催化剂用量。
(实验记录)
同学们进行6组实验,实验记录如下:
实验序号 | ① | ② | ③ | ④ | ⑤ | ⑥ |
过氧化氢溶液的 浓度(%) | 30 | 30 | 15 | 30 | 30 | 30 |
过氧化氢溶液的 体积(mL) | 6 | x | 6 | 6 | 6 | 6 |
水槽中水的温度 | 20 | 90 | 70 | 70 | 20 | 20 |
锥形瓶中的物质 | 0.1g MnO2 | 0.5g MnO2 | ||||
6min内产生氧气(mL) | 0.0 | 41.0 | 4.5 | 12.1 | 2.0 | 650.0 |
(解释与结论)
(1)实验②中应加入过氧化氢溶液的体积x是________mL。
(2)实验①-⑥可以通过测定__________来比较过氧化氢的分解速率。
A 相同时间内产生氧气的体积
B 产生相同体积的氧气所需时间
C 相同时间内产生氧气的质量
(3)得出“过氧化氢溶液的浓度越大分解速率越快”结论所依据的实验是____(填序号)。
(4)通过实验①、②、④可得出的结论是_________。
(反思与评价)
(5)同学们认为实验室制氧气,应选择实验⑥而不选实验②的理由是________(答一点即可)