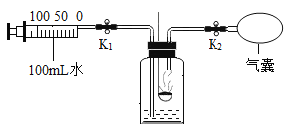
题目内容
【题目】图中A、B分别是某微粒的结构示意图,回答下列问题:
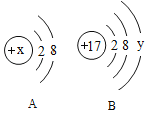
(1)若A表示某稀有气体元素的原子,则该元素的单质的化学式为_____。
(2)若B表示某元素的原子,则y=_____,该元素的原子在化学反应中容易_____(填“失去”或“得到”)电子,形成_____(填离子符号)。
(3)若A是阳离子的结构示意图,则x可能是下列中的_____(填字母序号)。
a.8 b.10 c. 11 d.12
(4)若A中x=11,则A、B所表示的元素形成化合物的名称为_____。
(5)决定元素化学性质的是_____。
【答案】Ne 7 得到 Cl- cd 氯化钠 最外层电子数
【解析】
(1)因为原子中质子数等于电子数,所以A的元素名称是氖,该元素的单质的化学式为Ne。故填:Ne。
(2)由于原子中,质子数等于电子数,所以y的数值等于7,最外层电子数是7的原子,在化学反应中容易得到一个电子而形成带有一个单位负电荷的氯离子,而成为稳定的结构;故填:7;得到;Cl-。
(3)因为阳离子是原子失去电子后的结果,而最外层电子数小于4的易失电子而成为阳离子,所以可据此判断;
a、质子数是8的原子最外层电子数是6,易得电子变成阴离子;
b、质子数是10的原子最外层电子数是8,不易得失电子;
c、质子数是11的原子最外层电子数是1,易失去这1个电子;
d、质子数是12的原子最外层电子数是2,易失去这2个电子;故填:cd。
(4)若A中x=11,则A元素是钠元素,化合价一般为+1价,由分析知B为氯元素,化合价一般为-1价,则A、B所表示的元素形成化合物的化学式为NaCl,名称为氯化钠;故填:氯化钠。
(5)最外层电子数决定元素的化学性质;故填:最外层电子数。

 阅读快车系列答案
阅读快车系列答案【题目】I.如图是一瓶医用注射盐水标签的部分内容。完成下列填空:
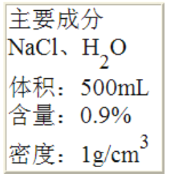
(1)氯化钠中钠、氯元素的质量比是_____;
(2)氯化钠中钠元素的质量分数是_____(精确到0.1%);
(3)该瓶盐水能给病人提供氯化钠的质量是_____g;
(4)该瓶盐水能给病人提供钠元素的质量是_____g (精确到0.1g)。
Ⅱ.在一定条件下,向一密闭容器内加入ABCD四种物质各20克,充分反应后测定其质量,得到数据如下,回答下列有关问题:
物质 | A | B | C | D |
反应前质量(克) | 20 | 20 | 20 | 20 |
反应后质量(克) | 20 | 30 | 未知 | 14 |
(1)这一反应类型是_____,未知值为_____。
(2)由表中数据分析可知,A可能没有参加化学反应,也可能是该反应的_____。
(3)写出一例与上述反应类型相同的反应化学方程式_____。
Ⅲ.如图A、B、C三种物质都含有同一种元素,B是单质, A、C都是氧化物,C是一种黑色固体物质。请回答:
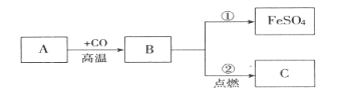
(1)写出A的化学式_____;
(2)写出反应②的化学方程式为_____;
(3)指明反应①基本反应类型_____。
【题目】某化学兴趣小组同学在回收废旧电池的同时,开展了如下的实验探究。
[查阅资料]废旧干电池填料的主要成分为二氧化锰、炭粉、氯化铵和氯化锌等,其中氯化铵、氯化锌可溶于水。兴趣小组同学将废旧干电池卸下的锌筒、碳棒冲洗干净备用。
实验一:检验废干电池筒内黑色固体中的存在。兴趣小组同学设计了如图所示的实验
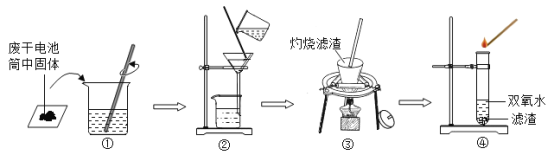
(1)操作②中玻璃棒的作用是________。
(2)操作③灼烧黑色滤渣时,会产生一种气体能使澄清石灰水变浑浊;操作④试管中产生的气体能使带火星木条复燃,写出试管中发生的化学方程式_______。
(3)由此得出结论:滤渣中除含有MnO2外,还含有黑色粉末______。
实验二:探究处理干净的二氧化锰在氯酸钾分解反应中的分解作用。
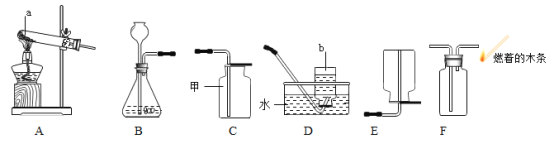
(1)写出甲所指的仪器名称______组装A装置时,固定试管应在放置酒精灯之_____(填 “前”或者“后”)进行。
(2)欲用氯酸钾制取比较纯净的氧气,则应选择的组合是_____若用该装置收集的氧气也不纯,原因可能是.______现改用高锰酸钾制取氧气,则发生装置需要改进之处是._______写出其化学方程式______。
(3)选用F装置采用“排空气法”收集并验满氧气,请在图中将导管补画完整。_____
(4)课后查阅资料后,小组利用如图1所示装置对氯酸钾制取氧气进行了深入的研究学习。
[资料]①氯酸钾的熔点约为356℃,二氧化锰的分解温度约为535℃.用酒精灯给物质加热,受热物质的温度一般约为400℃左右;
②不同配比是指氯酸钾和二氧化锰混合物中,氯酸钾和二氧化锰的质量比;
③氯酸钾分解时,传感器测得氧气浓度随温度的变化示意图(图2)及不同配比时氧气浓度随温度的变化示意图(图3)如下:
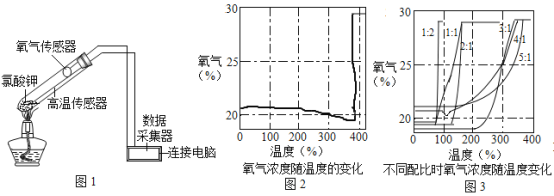
请回答问题:
①分析图2,氯酸钾熔点______(填“高于”、“等于”或“低于")共分解温度。
②分析图2,在氯酸钾分解前,传感器测得氧气浓度降低的可能原因______。
③分析图3,氯酸钾分解温度随物质配比变化的规律是_____。
实验三:利用产生的氧气做完“铁在氧气里燃烧’的实验后,小组同学对掉落下来的黑色熔融物成分产生了好奇。查阅资料得知:自然界中铁的氧化物主要是Fe2O3和Fe3O4两种(Fe2O3为暗红色,FeO极易氧化)。小组同学将冷却后的黑色物质碾碎,经实验,发现溅落下来的黑色物质中还有铁。但铁燃烧的产物为什么不是Fe2O3呢?
[查阅资料]①Fe2O3和Fe3O4的分解温度见下表:②Fe2O3高温分解成Fe3O4
Fe3O4 | Fe2O3 | 铁 | |
分解温度/℃ | 1538 | 1400 | - |
熔点/℃ | - | - | 1535 |
[讨论和交流]根据实验现象,并结合表中数据,可推知铁在氧气里燃烧时产生的高温应在____之间。
[拓展延伸]①Fe2O3高温时会分解成Fe3O4和一种气体, 请写出此反应的化学方程式_____。
②有些超市的食品密封包装盒的透明盖内放有黑色的氧化亚铁粉末,若粉末的颜色_____,就说明包装盒破损进气,这样售货员就能及时发现并处理.