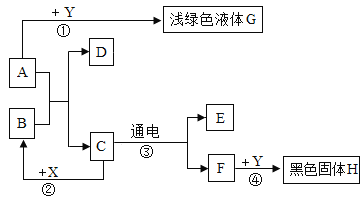
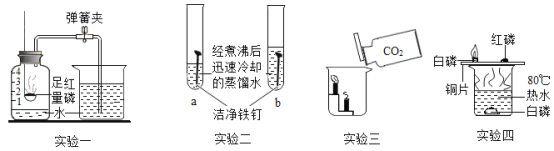
题目内容
【题目】实验室使用大理石和盐酸反应制取的![]() 是不纯净的,为证明该气体中含有多种物质,所用的试剂及使用顺序正确的是:
是不纯净的,为证明该气体中含有多种物质,所用的试剂及使用顺序正确的是:
A.无水硫酸铜、硝酸银溶液、石灰水B.浓硫酸、氢氧化钠溶液、石灰水
C.硝酸银溶液、石灰水、无水硫酸铜D.氧化钙、石蕊试液、水
【答案】A
【解析】
A、气体通入无水硫酸铜,无水硫酸铜变蓝,证明有水存在;再通入硝酸银溶液中,由白色沉淀生成,证明有氯化氢存在;最后通入澄清石灰水,澄清石灰水变浑浊,证明有二氧化碳存在,故A正确;
B、浓硫酸可以干燥气体,不能证明水的存在,氢氧化钠和二氧化碳、氯化氢反应,除去二氧化碳和氯化氢,无法证明有水、氯化氢,故B错误;
C、先通入硝酸银,会使气体中混有水蒸气,无法判断原来有没有水蒸气,故C错误;
D、氯化钙可以干燥气体,氯化氢和二氧化碳通入石蕊试液能使石蕊试液变红,无法证明有水和氯化氢,故D错误。故选A。

 阅读快车系列答案
阅读快车系列答案【题目】下列选项中都有Ⅰ、Ⅱ、Ⅲ三种溶液,在![]() 溶液中加入Ⅰ溶液,产生白色沉淀,再加入Ⅱ溶液,沉淀溶解,并有气泡产生,然后再继续加人Ⅲ溶液,又产生白色沉淀。符合上述变化的选项是:
溶液中加入Ⅰ溶液,产生白色沉淀,再加入Ⅱ溶液,沉淀溶解,并有气泡产生,然后再继续加人Ⅲ溶液,又产生白色沉淀。符合上述变化的选项是:
A | B | C | D | |
Ⅰ |
|
|
|
|
Ⅱ |
|
|
|
|
Ⅲ | KCl |
|
|
|
A.AB.BC.CD.D
【题目】下表是空气中的气体成分和人体呼出的气体成分含量对照表:
气体成分 | 氮气 | 氧气 | 二氧 化碳 | 水 | 其他 气体 |
空气中的气体/% | 78 | 21 | 0.03 | 0.07 | 0.9 |
呼出的气体/% | 78 | 16 | 4 | 1.1 | 0.9 |
某校研究性学习小组的同学设计了简单的实验方案,验证呼出的气体与吸入空气成分的含量的不同,其主要操作步骤如下图所示。
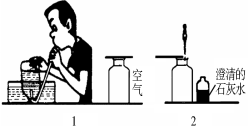
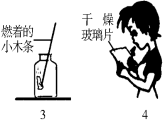
请依据图示将主要实验操作步骤及验证依据填入下表中:
实验步骤 | 验证依据 |
(1)___________________________________ | — |
(2)___________________________________ | 根据________________________判断CO2含量不同 |
(3)___________________________________ | 根据________________________判断O2含量不同 |
(4)___________________________________ | 根据________________________判断含水量不同 |
【题目】某化学兴趣小组的同学在学习九年级《化学》下册中的资料卡片“石笋和钟乳石的形成”时,发现难溶于水的碳酸钙当遇到溶有二氧化碳的水时,会反应生成溶解性较大的碳酸氢钙:CaCO3+CO2+H2O=Ca(HCO3)2,联想到实验室中澄清石灰水与二氧化碳反应会生成碳酸钙:Ca(OH)2+CO2=CaCO3↓+H2O,对长时间向碱溶液中通入CO2反应后溶液中的溶质组成产生了浓度的兴趣。
(提出问题)一定量CO2与NaOH溶液反应后的溶质组成是什么?
(查阅资料)(1)通入少量CO2反应的化学方程式为:_____。
(2)通入过量CO2,反应的化学方程式为:Na2CO3+CO2+H2O=2NaHCO3。
(3)碳酸氢盐都是可溶于水的,BaCO3难溶于水。
(4)碳酸氢钠溶液呈碱性。
(提出猜想)(1)溶质为NaOH和Na2CO3;
(2)溶质为Na2CO3;
(3)溶质为_____(填化学式);
(4)溶质为NaHCO3。
(设计实验)
实验步骤 | 实验现象 | 实验结论 |
(1)用玻璃棒蘸取反应后溶液,滴在pH试纸上 | pH=9 | 该溶液显碱性 |
(2)取反应后溶液少许于试管中,向其中滴加过量的BaCl2溶液 | 有_____生成 | 猜想(4)不成立 |
(3)取步骤(2)中的上层清液,滴入稀盐酸 | 有气泡冒出 | 猜想(1)和(2)不成立 |
(得出结论)猜想(3)成立。
(讨论交流)(1)有同学提出,实验步骤(1)是多余的。你认为该实验设计是否需要?_____(填“需要”或“不需要”)。
(2)同学们又一次把目光投向了教材,发现遇热或压强变小时:Ca(HCO3)2=CaCO3↓+CO2↑+H2O,纷纷提出,干粉灭火器中用NaHCO3灭火的反应原理与之相似,试写出NaHCO3受热分解的化学方程式_____。
(反思应用)同学们回忆起实验室检验二氧化碳的情景,心想:如果向澄清石灰水中不断通入二氧化碳,会看到怎样的现象呢?请你描述一下:_____。