题目内容
23、已知某合金粉末除铝外,还含有铁、铜中的一种或两种.某兴趣小组在老师的指导下,对合金粉末中铁、铜的存在情况进行了探究.
查阅资料 铝与氢氧化钠溶液反应方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑( 产物NaAlO2溶于水),Fe、Cu不与氢氧化钠溶液反应.
猜想
猜想Ⅰ:该合金粉末中除铝外,还含有铁.
猜想Ⅱ:该合金粉末中除铝外,还含有
猜想Ⅲ:该合金粉末中除铝外,还含有铁、铜.
实验探究 现进行如下实验:

探究结论
(1)加入过量NaOH溶液后得到的气体A是
(2)固体A加过量的稀盐酸,固体部分溶解,并有气体放出,溶液呈浅绿色,说明合金中一定含有
反思 一般来说,活泼金属能与盐酸等酸反应,而铝与酸、碱都能反应,说明铝具有特殊的性质,写出铝与稀盐酸反应的化学方程式
查阅资料 铝与氢氧化钠溶液反应方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑( 产物NaAlO2溶于水),Fe、Cu不与氢氧化钠溶液反应.
猜想
猜想Ⅰ:该合金粉末中除铝外,还含有铁.
猜想Ⅱ:该合金粉末中除铝外,还含有
铜
(填名称)猜想Ⅲ:该合金粉末中除铝外,还含有铁、铜.
实验探究 现进行如下实验:

探究结论
(1)加入过量NaOH溶液后得到的气体A是
氢气
由该实验说明合金中一定含有铝
(2)固体A加过量的稀盐酸,固体部分溶解,并有气体放出,溶液呈浅绿色,说明合金中一定含有
铁和铜
由此验证猜想Ⅲ
成立.反思 一般来说,活泼金属能与盐酸等酸反应,而铝与酸、碱都能反应,说明铝具有特殊的性质,写出铝与稀盐酸反应的化学方程式
2Al+6HCl=2AlCl3+3H2↑
.分析:根据题目所给信息,在验证合金中是否有铝时,我们可以利用铝和氢氧化钠溶液反应生成偏铝酸钠和氢气来鉴定.而铁和铜在鉴定时,可以根据铁与氢氧化钠不反应而与盐酸反应,铜两者都不反应来;根据化学方程式的书写原则和反应规律书写化学方程式.
解答:解:根据所给的猜想我们可以确定猜想2,可能含有铜.
(1)因为氢氧化钠和铝反应生成氢气,故肯定含有铝.
(2)检验是否有铁时,可用稀盐酸来检验.检验是否有铜时,利用铜和稀盐酸不能反应来进行,因为固体A加过量的稀盐酸,固体部分溶解,并有气体放出,溶液呈浅绿色,说明合金中一定含有铁和铜.
铝与稀盐酸反应的化学方程式 2Al+6HCl=2AlCl3+3H2↑.
故答案为:
【猜想】铜(或Cu)
【探究结论】(1)氢气(或H2),铝(或Al)
(2)铁、铜(或Fe、Cu),Ⅲ
【反思】2Al+6HCl=2AlCl3+3H2↑
(1)因为氢氧化钠和铝反应生成氢气,故肯定含有铝.
(2)检验是否有铁时,可用稀盐酸来检验.检验是否有铜时,利用铜和稀盐酸不能反应来进行,因为固体A加过量的稀盐酸,固体部分溶解,并有气体放出,溶液呈浅绿色,说明合金中一定含有铁和铜.
铝与稀盐酸反应的化学方程式 2Al+6HCl=2AlCl3+3H2↑.
故答案为:
【猜想】铜(或Cu)
【探究结论】(1)氢气(或H2),铝(或Al)
(2)铁、铜(或Fe、Cu),Ⅲ
【反思】2Al+6HCl=2AlCl3+3H2↑
点评:原来我们学习碱的性质时,碱不与活泼金属反应,而从所给的信息中,我们知道铝可以和氢氧化钠反应,所以这要求我们在运用知识时,不能盲目的运用所学知识,要根据所题目的意境来解决题目.

练习册系列答案
相关题目


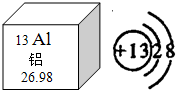 铝被称为“年轻的金属”,据世界化学史记载,金属铝是在1825年才被英国化学家戴维制得.今天,铝已经进入了我们生活的每一个角落.
铝被称为“年轻的金属”,据世界化学史记载,金属铝是在1825年才被英国化学家戴维制得.今天,铝已经进入了我们生活的每一个角落.