题目内容
聚丙烯(PP塑料)是生活中一种很常见的塑料,可用于生产塑料饭盒、一次性水杯等.某化学研究小组的同学欲研究PP塑料的组成,他们设计了如图所示的实验装置(气密性良好),使该塑料样品在纯氧中燃烧,观察实验现象,分析有关数据,推算PP塑料的组成.主要实验步骤如下: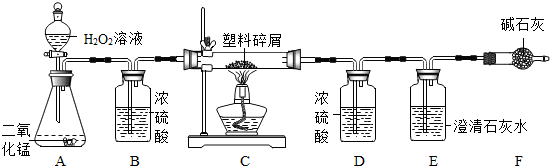
Ⅰ,称取塑料样品碎屑4.2g,装入玻璃管中,并分别称量D、E装置质量分别是132.3g和112.4g,连接好A、B、C装置
Ⅱ,向分液漏斗中加入足量5%的过氧化氢溶液,打开分液漏斗的旋塞,一段时间后连接D、E、F装置并点燃酒精灯
Ⅲ,待C中发生反应,熄灭酒精灯,充分冷却后关闭分液漏斗的旋塞
Ⅳ,再次称量D、E装置质量分别是137.7g和125.6g
已知:浓硫酸能吸收 水分,氢氧化钠溶液能吸收二氧化碳气体,碱石灰能吸收水和二氧化碳;C中塑料碎屑完全燃烧,B、D、E装置能完全吸收相关物质.
(1)仪器A中所发生的化学反应方程式为 ;该反应属于 反应
(2)步骤Ⅱ中“代开分液漏斗的旋塞,一段时间后”再进行其他操作的目的是
(3)小组成员小胡对比称量结果发现D、E装置的物质都增加了,于是他马上告诉大家PP塑料是由碳、氢、氧三种元素组成的,小组成员讨论后认定他的结论是错误的,理由是
(4)小聪同学经过仔细分析和计算的处理正确的结论:PP塑料由 元素组成它们的质量比是 (填最简整数比);丙计算出了与塑料碎屑反应的氧气的质量
(5)若装置中没有连接仪器B,将使该塑料式样中氢元素的质量测算结果 (填“偏小”“偏大”“无影响”中之一)

Ⅰ,称取塑料样品碎屑4.2g,装入玻璃管中,并分别称量D、E装置质量分别是132.3g和112.4g,连接好A、B、C装置
Ⅱ,向分液漏斗中加入足量5%的过氧化氢溶液,打开分液漏斗的旋塞,一段时间后连接D、E、F装置并点燃酒精灯
Ⅲ,待C中发生反应,熄灭酒精灯,充分冷却后关闭分液漏斗的旋塞
Ⅳ,再次称量D、E装置质量分别是137.7g和125.6g
已知:浓硫酸能吸收 水分,氢氧化钠溶液能吸收二氧化碳气体,碱石灰能吸收水和二氧化碳;C中塑料碎屑完全燃烧,B、D、E装置能完全吸收相关物质.
(1)仪器A中所发生的化学反应方程式为
(2)步骤Ⅱ中“代开分液漏斗的旋塞,一段时间后”再进行其他操作的目的是
(3)小组成员小胡对比称量结果发现D、E装置的物质都增加了,于是他马上告诉大家PP塑料是由碳、氢、氧三种元素组成的,小组成员讨论后认定他的结论是错误的,理由是
(4)小聪同学经过仔细分析和计算的处理正确的结论:PP塑料由
(5)若装置中没有连接仪器B,将使该塑料式样中氢元素的质量测算结果
考点:实验探究物质的组成成分以及含量,测量容器-量筒,常见气体的检验与除杂方法,实验室制取氧气的反应原理,反应类型的判定,书写化学方程式、文字表达式、电离方程式
专题:科学探究
分析:(1)通常情况下,过氧化氢在二氧化锰的催化作用下,分解生成水和氧气;
(2)因为装置中空气中的水蒸气和二氧化碳会影响实验结果,因此步骤Ⅱ中“打开分液漏斗的旋塞,一段时间后”再进行其他操作,目的是排出装置中的空气;
(3)D、E装置的物质增加,是因为吸收了水和二氧化碳的结果;
根据水的质量可以计算塑料中氢元素的质量,根据二氧化碳的质量可以计算塑料中碳元素的质量,进一步可以计算塑料中氧元素的质量;
(4)通过计算可以判断塑料的元素组成及其组成元素的质量比,同时能够计算与塑料碎屑反应的氧气的质量;
(5)若装置中没有连接仪器B,会导致测定的生成水的质量偏大,从而导致该塑料式样中氢元素的质量测算结果偏大.
(2)因为装置中空气中的水蒸气和二氧化碳会影响实验结果,因此步骤Ⅱ中“打开分液漏斗的旋塞,一段时间后”再进行其他操作,目的是排出装置中的空气;
(3)D、E装置的物质增加,是因为吸收了水和二氧化碳的结果;
根据水的质量可以计算塑料中氢元素的质量,根据二氧化碳的质量可以计算塑料中碳元素的质量,进一步可以计算塑料中氧元素的质量;
(4)通过计算可以判断塑料的元素组成及其组成元素的质量比,同时能够计算与塑料碎屑反应的氧气的质量;
(5)若装置中没有连接仪器B,会导致测定的生成水的质量偏大,从而导致该塑料式样中氢元素的质量测算结果偏大.
解答:解:(1)仪器A中所发生的化学反应方程式为:2H2O2
2H2O+O2↑,该反应属于分解反应.
故填:2H2O2
2H2O+O2↑;分解.
(2)步骤Ⅱ中“代开分液漏斗的旋塞,一段时间后”再进行其他操作的目的是排出装置中的空气,以免影响实验结果.
故填:把装置中的空气排出.
(3)因为水和二氧化碳中的氧元素可能来自于PP塑料和氧气,也可能完全来自于氧气,所以不能确定塑料中是否含有氧元素.
故填:水和二氧化碳中的氧元素可能来自于PP塑料和氧气,也可能完全来自于氧气.
(4)D、E装置质量分别是137.7g和125.6g,说明生成水的质量为:137.7g-132.3g=5.4g,生成二氧化碳的质量为:125.6g-112.4g=13.2g,
5.4g水中氢元素的质量为:5.4g×
×100%=0.6g,氧元素的质量为:5.4g-0.6g=4.8g;
13.2g二氧化碳中碳元素的质量为:13.2g×
×100%=3.6g,氧元素的质量为:13.2g-3.6g=9.6g;
4.2g塑料中氧元素的质量为:4.2g-0.6g-3.6g=0,
因此塑料中只含有碳元素和氢元素,并且碳元素和氢元素的质量比为:3.6g:0.6g=6:1;
与塑料碎屑反应的氧气的质量为:5.4g+13.2g-4.2g=14.4g.
故填:碳和氢;6:1;14.4g.
(5)若装置中没有连接仪器B,将使测定的水的质量偏大,从而使该塑料中氢元素的质量测算结果偏大.
故填:偏大.
| ||
故填:2H2O2
| ||
(2)步骤Ⅱ中“代开分液漏斗的旋塞,一段时间后”再进行其他操作的目的是排出装置中的空气,以免影响实验结果.
故填:把装置中的空气排出.
(3)因为水和二氧化碳中的氧元素可能来自于PP塑料和氧气,也可能完全来自于氧气,所以不能确定塑料中是否含有氧元素.
故填:水和二氧化碳中的氧元素可能来自于PP塑料和氧气,也可能完全来自于氧气.
(4)D、E装置质量分别是137.7g和125.6g,说明生成水的质量为:137.7g-132.3g=5.4g,生成二氧化碳的质量为:125.6g-112.4g=13.2g,
5.4g水中氢元素的质量为:5.4g×
| 2 |
| 18 |
13.2g二氧化碳中碳元素的质量为:13.2g×
| 12 |
| 44 |
4.2g塑料中氧元素的质量为:4.2g-0.6g-3.6g=0,
因此塑料中只含有碳元素和氢元素,并且碳元素和氢元素的质量比为:3.6g:0.6g=6:1;
与塑料碎屑反应的氧气的质量为:5.4g+13.2g-4.2g=14.4g.
故填:碳和氢;6:1;14.4g.
(5)若装置中没有连接仪器B,将使测定的水的质量偏大,从而使该塑料中氢元素的质量测算结果偏大.
故填:偏大.
点评:合理设计实验,科学地进行实验、分析实验,是得出正确实验结论的前提,因此要学会设计实验、进行实验、分析实验,为学好化学知识奠定基础.

练习册系列答案
相关题目
在20℃时,向100g KNO3饱和溶液中加入5g KNO3晶体,则( )
| A、KNO3晶体的质量减少 |
| B、溶液中KNO3的质量分数增大 |
| C、KNO3晶体的质量不变 |
| D、KNO3的溶解度变化 |
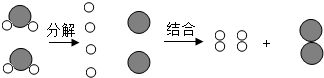 为了表示一个化学反应,我们曾使用过文字表达式、图示和符号表达式等多种方法,每一种表示方法都能反映出许多有关化学反应的信息,下面是电解水的简单图示,请仔细分析图,从获取的信息中谈谈你对化学反应的认识(答出三点即可):
为了表示一个化学反应,我们曾使用过文字表达式、图示和符号表达式等多种方法,每一种表示方法都能反映出许多有关化学反应的信息,下面是电解水的简单图示,请仔细分析图,从获取的信息中谈谈你对化学反应的认识(答出三点即可): 化学为交通运输做出很多贡献.请回答下列问题:
化学为交通运输做出很多贡献.请回答下列问题:
 已知A~D是初中化学常见物质.A、C、D含有同种元素,常温常压下A、B为黑色固体,C、D为气体,它们之间的转化关系如图(反应条件及部分生成物省略),其中反应①的实验现象为黑色粉末逐渐变红根据以上信息回答下列问题
已知A~D是初中化学常见物质.A、C、D含有同种元素,常温常压下A、B为黑色固体,C、D为气体,它们之间的转化关系如图(反应条件及部分生成物省略),其中反应①的实验现象为黑色粉末逐渐变红根据以上信息回答下列问题