题目内容
4.通过一段时间的化学学习,相信你已经掌握了实验室制取氧气的有关知识.请结合图示回答问题.
(1)写出图中标示的仪器名称:①酒精灯 ②集气瓶.
(2)实验室用氯酸钾和二氧化锰制取氧气:
写出该反应的化学方程式2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑,属于分解反应(填基本反应类型).若需要比较纯净的氧气用作铁丝燃烧实验,则收集装置最好选用F(填序号),运用以上收集装置的原因是做此实验时集气瓶底部要留少量水;防止溅落物炸裂瓶底.铁丝在氧气中燃烧的化学方程式3Fe+2O2$\frac{\underline{\;点燃\;}}{\;}$Fe3O4;实验现象剧烈燃烧,火星四射,放出大量的热,生成一种黑色固体.
(4)小珍阅读课外资料得知:用氯酸钾制取氧气时,除了用二氧化锰还可用氧化铜等物质作催化剂,于是她对氧化铜产生了探究兴趣.
【提出问题】氧化铜是否也能作氯酸钾分解的催化剂?它是否比二氧化锰催化效果更好?
【查阅资料】二氧化锰、氧化铜均为不溶于水的黑色粉末.
【设计实验】小珍以生成等体积的氧气为标准,设计了下列三组实验:
| 实验序号 | 氯酸钾质量 | 其它物质质量 | 待测数据 |
| ① | 1.2g | / | |
| ② | 1.2g | 氧化铜0.5g | |
| ③ | 1.2g | 二氧化锰0.5g |
Ⅰ、上述实验应测量的“待测数据”是收集等量氧气所需时间.
Ⅱ、若实验②比实验①的“待测数据”更小(填“大”或“小”),说明氧化铜能加快氯酸钾的分解速率.
【质疑】这样能说明氧化铜是氯酸钾分解的催化剂吗?
【预期结论】不能.
【设计实验】将实验②反应后的固体加水充分溶解、过滤、洗涤、干燥、称量,此过程中需要用到的玻璃仪器有烧杯、漏斗、玻璃棒,第二步操作时耗时较长的原因可能是操作不规范.
若最终称量得到0.5g黑色粉末,应再将黑色粉末放入试管中,向试管中倒入适量的氯酸钾,混合均匀后加热,产生使带火星的木条复燃的气体(简述操作和现象).
【结论】氧化铜能作氯酸钾的催化剂.
【评价设计】你认为小珍设计实验③和实验②对比的目的是探究氧化铜和二氧化锰哪一个催化效果好.
(3)若用图I装置收集较为干燥的氧气,如何验满?将带火星的木条放在集气瓶口,如果复燃,说明收集满了.
(4)实验室用装置E制取氧气,如用注射器C替换长颈漏斗,优点是能够控制反应速率.
(5)注射器C也可用于检查装置E的气密性,步骤如下:
Ⅰ、向锥形瓶中加入少量水,使长颈漏斗插入液面以下.Ⅱ、将注射器C连接到装置E的导管口处.Ⅲ、缓慢拉动注射器C的活塞,观察到长颈漏斗下端形成一段水柱,表示装置E的气密性良好.
分析 (1)要熟悉各种仪器的名称、用途和使用方法;
(2)氯酸钾在二氧化锰的催化作用下,受热分解生成氯化钾和氧气;氧气不易溶于水,密度比空气大;若收集一瓶供铁丝在氧气中燃烧的实验使用的氧气,由于在集气瓶的底部须加少量的水,最好用排水法收集.
Ⅰ、运用催化剂的概念和本题的实验目的证明氧化铜能加快氯酸钾的分解解答.
Ⅱ、如果氧化铜能加快氯酸钾的分解速率,实验②比实验①所用时间小.
【设计实验】根据实验②反应后的固体只有氧化铜,而且预期结论是:氧化铜还能作氯酸钾分解的催化剂,分析解答.
【评价设计】实验③和实验②对比的目的是探究氧化铜和二氧化锰哪一个催化效果好.
(3)根据氧气具有助燃性,能使带火星的木条复燃考虑本题.
(4)注射器能够控制液体药品的流量,从而可以控制反应速率;
(5)根据操作中压强的有关知识分析.
解答 解:(1)图中标示的仪器名称:①为酒精灯; ②为集气瓶.
(2)氯酸钾在二氧化锰的催化作用下受热分解的化学方程式为:2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑;氧气的密度比空气大,可以用向上排空气法收集,即用D装置收集,氧气不易溶于水,可以用排水法收集,即用E装置收集.而若收集一瓶氧气,供铁丝在氧气中燃烧的实验使用,最好选用排水法收集,气体的收集装置最好用F,因为做此实验时集气瓶底部要留少量水;铁丝在氧气中燃烧生成四氧化三铁,反应的化学方程式为3Fe+2O2$\frac{\underline{\;点燃\;}}{\;}$Fe3O4;实验现象剧烈燃烧,火星四射,放出大量的热,生成一种黑色固体.
Ⅰ、本题的实验目的证明氧化铜能加快氯酸钾的分解,所以“待测数据”是收集等量氧气所需时间.故答案为:收集等量氧气所需时间.
Ⅱ、如果氧化铜能加快氯酸钾的分解速率,实验②比实验①所用时间小.故答案为:小.
(3)将实验②反应后的固体加水溶解、过滤、洗涤、干燥、称量,第二步操作时耗时较长的原因可能是操作不规范.若最终称量得到0.5g黑色粉末,推测实验②反应后的固体只有氧化铜,而且正好是加入的氧化铜的量,而且预期结论是:氧化铜还能作氯酸钾分解的催化剂,所以我们可以向试管中倒入适量的氯酸钾,混合均匀后加热,产生使带火星的木条复燃的气体,说明氧化铜有催化作用.故答案为:向试管中倒入适量的氯酸钾,混合均匀后加热,产生使带火星的木条复燃的气体.
【评价设计】实验③和实验②对比的目的是探究氧化铜和二氧化锰哪一个催化效果好.故答案为:探究氧化铜和二氧化锰哪一个催化效果好;
(3)氧气具有助燃性,能支持燃烧,能使带火星的木条复燃,所以用向上排空气法收集氧气验满方法:将带火星的木条放在集气瓶口,如果复燃,说明收集满了.
(4)实验室用装置E制取氧气时,如用注射器C替换长颈漏斗,优点是能够控制反应速率.故填:能够控制反应速率.
(5)用注射器C检查装置E的气密性时,向锥形瓶中加入少量水至浸没长颈漏斗下端,将注射器C连接到装置E的导管口处,缓慢推动注射器C的活塞,装置内的压强增大,因此观察到长颈漏斗下端形成一段水柱.
故答案为:
(1)①酒精灯; ②集气瓶.
(2)2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑,分解反应; F; 做此实验时集气瓶底部要留少量水; 防止溅落物炸裂瓶底. 3Fe+2O2$\frac{\underline{\;点燃\;}}{\;}$Fe3O4;剧烈燃烧,火星四射,放出大量的热,生成一种黑色固体.
Ⅰ、收集等量氧气所需时间.Ⅱ、小.
【设计实验】过滤、干燥、漏斗、玻璃棒,操作不规范.向试管中倒入适量的氯酸钾,混合均匀后加热,产生使带火星的木条复燃的气体.
【评价设计】探究氧化铜和二氧化锰哪一个催化效果好.
(3)将带火星的木条放在集气瓶口,如果复燃,说明收集满了.(4)能够控制反应速率.(5)长颈漏斗下端形成一段水柱,
点评 本题考虑选择发生装置时,要考虑反应物的状态、反应条件等因素;选择收集装置时,要考虑气体的水溶性、密度、能否和空气中的物质发生化学反应等因素;催化剂只是改变反应的速率,对反应的生成物及生成物的量都没有影响,本身的质量不变.抓住催化剂的质量反应前后不变和能加快其他物质的化学反应速率这两个性质探究.

| 物质 | X | Y | Z | W |
| 反应前质量/g | 10 | 3 | 90 | 0 |
| 反应后质量/g | 3.2 | 3 | 待测 | 3.2 |
| A. | 反应中X和W的质量变化比为 17:8 | B. | Y可能是催化剂 | ||
| C. | 该反应是分解反应 | D. | 反应后Z物质的质量为86.4g |
| A. | 将鼻孔凑到容器口去闻药品的气味 | |
| B. | 加热过药品的试管要趁热清洗,以免洗不干净 | |
| C. | 试管可直接用酒精灯加热 | |
| D. | 为了节约火柴,可用燃着的酒精灯点燃另一盏酒精灯 |
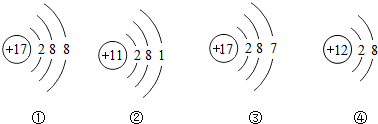
| A. | ①③属于同种元素 | |
| B. | ①④都属于离子,都是稳定结构 | |
| C. | ②③的化学性质相似 | |
| D. | ②④表示的元素在化合物中分别通常显+1和+2价 |
| A. | 碳酸钙 $\stackrel{加热}{→}$氧化钙+二氧化碳 | B. | 镁+氧气$\stackrel{点燃}{→}$氧化镁 | ||
| C. | 甲烷+氧气$\stackrel{点燃}{→}$二氧化碳+水 | D. | 氯酸钾$\stackrel{加热}{→}$氯化钾+氧气 |
| A. | 冰雪融化 | B. | 房屋倒塌 | C. | 火山喷发 | D. | 山体滑坡 |
 钙尔奇,首个进入中国的国际知名钙补充剂品牌,被众多中国医学专家和营养学专家推荐用于预防和治疗骨质疏松症,也是全球医生推荐最多的钙质剂品牌.钙是人体必须的常量元素,每日必须摄入足够量的钙,下面是补钙药品的部分说明书,请据图回答下列问题:
钙尔奇,首个进入中国的国际知名钙补充剂品牌,被众多中国医学专家和营养学专家推荐用于预防和治疗骨质疏松症,也是全球医生推荐最多的钙质剂品牌.钙是人体必须的常量元素,每日必须摄入足够量的钙,下面是补钙药品的部分说明书,请据图回答下列问题: