题目内容
13.下列反应中,不属于分解反应,也不属于化合反应的是( )| A. | 碳酸钙 $\stackrel{加热}{→}$氧化钙+二氧化碳 | B. | 镁+氧气$\stackrel{点燃}{→}$氧化镁 | ||
| C. | 甲烷+氧气$\stackrel{点燃}{→}$二氧化碳+水 | D. | 氯酸钾$\stackrel{加热}{→}$氯化钾+氧气 |
分析 化合反应:两种或两种以上物质反应后生成一种物质的反应,其特点可总结为“多变一”;分解反应:一种物质反应后生成两种或两种以上的物质,其特点可总结为“一变多”;据此进行分析判断.
解答 解:A、碳酸钙 $\stackrel{加热}{→}$氧化钙+二氧化碳,该反应符合“一变多”的特征,属于分解反应,故选项错误.
B、镁在空气中燃烧生成氧化镁,该反应符合“多变一”的特征,属于化合反应,故选项错误.
C、甲烷+氧气$\stackrel{点燃}{→}$二氧化碳+水,该反应的反应物和生成物均是两种,不符合“多变一”的特征,不属于化合反应;也不符合“一变多”的特征,不属于分解反应,故选项正确.
D、氯酸钾在二氧化锰的催化作用下生成氯化钾和氧气,该反应符合“一变多”的特征,属于分解反应,故选项错误.
故选C.
点评 本题难度不大,掌握化合反应(“多变一”)、分解反应(“一变多”)的特征是正确解答本题的关键.

练习册系列答案
相关题目
3.某同学进行下列化学实验时,其数据和现象记录正确的是( )
| A. | 用托盘天平称取大理石2.01g | |
| B. | 用10mL量筒量取稀盐酸5mL | |
| C. | 氢氧化钠固体溶于水后溶液温度降低 | |
| D. | 氢气在空气中燃烧产生了淡蓝色火焰 |
4.通过一段时间的化学学习,相信你已经掌握了实验室制取氧气的有关知识.请结合图示回答问题.

(1)写出图中标示的仪器名称:①酒精灯 ②集气瓶.
(2)实验室用氯酸钾和二氧化锰制取氧气:
写出该反应的化学方程式2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑,属于分解反应(填基本反应类型).若需要比较纯净的氧气用作铁丝燃烧实验,则收集装置最好选用F(填序号),运用以上收集装置的原因是做此实验时集气瓶底部要留少量水;防止溅落物炸裂瓶底.铁丝在氧气中燃烧的化学方程式3Fe+2O2$\frac{\underline{\;点燃\;}}{\;}$Fe3O4;实验现象剧烈燃烧,火星四射,放出大量的热,生成一种黑色固体.
(4)小珍阅读课外资料得知:用氯酸钾制取氧气时,除了用二氧化锰还可用氧化铜等物质作催化剂,于是她对氧化铜产生了探究兴趣.
【提出问题】氧化铜是否也能作氯酸钾分解的催化剂?它是否比二氧化锰催化效果更好?
【查阅资料】二氧化锰、氧化铜均为不溶于水的黑色粉末.
【设计实验】小珍以生成等体积的氧气为标准,设计了下列三组实验:
(其它可能影响实验的因素均忽略).
Ⅰ、上述实验应测量的“待测数据”是收集等量氧气所需时间.
Ⅱ、若实验②比实验①的“待测数据”更小(填“大”或“小”),说明氧化铜能加快氯酸钾的分解速率.
【质疑】这样能说明氧化铜是氯酸钾分解的催化剂吗?
【预期结论】不能.
【设计实验】将实验②反应后的固体加水充分溶解、过滤、洗涤、干燥、称量,此过程中需要用到的玻璃仪器有烧杯、漏斗、玻璃棒,第二步操作时耗时较长的原因可能是操作不规范.
若最终称量得到0.5g黑色粉末,应再将黑色粉末放入试管中,向试管中倒入适量的氯酸钾,混合均匀后加热,产生使带火星的木条复燃的气体(简述操作和现象).
【结论】氧化铜能作氯酸钾的催化剂.
【评价设计】你认为小珍设计实验③和实验②对比的目的是探究氧化铜和二氧化锰哪一个催化效果好.
(3)若用图I装置收集较为干燥的氧气,如何验满?将带火星的木条放在集气瓶口,如果复燃,说明收集满了.
(4)实验室用装置E制取氧气,如用注射器C替换长颈漏斗,优点是能够控制反应速率.
(5)注射器C也可用于检查装置E的气密性,步骤如下:
Ⅰ、向锥形瓶中加入少量水,使长颈漏斗插入液面以下.Ⅱ、将注射器C连接到装置E的导管口处.Ⅲ、缓慢拉动注射器C的活塞,观察到长颈漏斗下端形成一段水柱,表示装置E的气密性良好.

(1)写出图中标示的仪器名称:①酒精灯 ②集气瓶.
(2)实验室用氯酸钾和二氧化锰制取氧气:
写出该反应的化学方程式2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑,属于分解反应(填基本反应类型).若需要比较纯净的氧气用作铁丝燃烧实验,则收集装置最好选用F(填序号),运用以上收集装置的原因是做此实验时集气瓶底部要留少量水;防止溅落物炸裂瓶底.铁丝在氧气中燃烧的化学方程式3Fe+2O2$\frac{\underline{\;点燃\;}}{\;}$Fe3O4;实验现象剧烈燃烧,火星四射,放出大量的热,生成一种黑色固体.
(4)小珍阅读课外资料得知:用氯酸钾制取氧气时,除了用二氧化锰还可用氧化铜等物质作催化剂,于是她对氧化铜产生了探究兴趣.
【提出问题】氧化铜是否也能作氯酸钾分解的催化剂?它是否比二氧化锰催化效果更好?
【查阅资料】二氧化锰、氧化铜均为不溶于水的黑色粉末.
【设计实验】小珍以生成等体积的氧气为标准,设计了下列三组实验:
| 实验序号 | 氯酸钾质量 | 其它物质质量 | 待测数据 |
| ① | 1.2g | / | |
| ② | 1.2g | 氧化铜0.5g | |
| ③ | 1.2g | 二氧化锰0.5g |
Ⅰ、上述实验应测量的“待测数据”是收集等量氧气所需时间.
Ⅱ、若实验②比实验①的“待测数据”更小(填“大”或“小”),说明氧化铜能加快氯酸钾的分解速率.
【质疑】这样能说明氧化铜是氯酸钾分解的催化剂吗?
【预期结论】不能.
【设计实验】将实验②反应后的固体加水充分溶解、过滤、洗涤、干燥、称量,此过程中需要用到的玻璃仪器有烧杯、漏斗、玻璃棒,第二步操作时耗时较长的原因可能是操作不规范.
若最终称量得到0.5g黑色粉末,应再将黑色粉末放入试管中,向试管中倒入适量的氯酸钾,混合均匀后加热,产生使带火星的木条复燃的气体(简述操作和现象).
【结论】氧化铜能作氯酸钾的催化剂.
【评价设计】你认为小珍设计实验③和实验②对比的目的是探究氧化铜和二氧化锰哪一个催化效果好.
(3)若用图I装置收集较为干燥的氧气,如何验满?将带火星的木条放在集气瓶口,如果复燃,说明收集满了.
(4)实验室用装置E制取氧气,如用注射器C替换长颈漏斗,优点是能够控制反应速率.
(5)注射器C也可用于检查装置E的气密性,步骤如下:
Ⅰ、向锥形瓶中加入少量水,使长颈漏斗插入液面以下.Ⅱ、将注射器C连接到装置E的导管口处.Ⅲ、缓慢拉动注射器C的活塞,观察到长颈漏斗下端形成一段水柱,表示装置E的气密性良好.
5.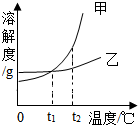 甲、乙两种物质溶解度曲线如图所示,下列叙述正确的是( )
甲、乙两种物质溶解度曲线如图所示,下列叙述正确的是( )
 甲、乙两种物质溶解度曲线如图所示,下列叙述正确的是( )
甲、乙两种物质溶解度曲线如图所示,下列叙述正确的是( )| A. | 依据溶解度曲线可判断:甲的溶解度比乙的大 | |
| B. | 将等质量的甲、乙的饱和溶液从t2℃降到t1℃,析出甲的质量大 | |
| C. | 将t2℃时甲的饱和溶液变为不饱和溶液,可采取降温的方法 | |
| D. | t2℃时,等质量的甲、乙饱和溶液中,溶质的质量相等 |
2.下列物质属于氧化物的是( )
| A. | 高锰酸钾 | B. | 氧气 | C. | 冰水混合物 | D. | 空气 |
 有“锂”走遍天下.锂电池广泛用于通信、电动车等行业,如图是锂的原子结构示意图和元素周期表中锂元素的部分信息,由此判断,锂原子在化学反应中易失去(选填“得到”或“失去”)电子,写出锂离子的符号Li+,氧化锂的化学式是Li2O.
有“锂”走遍天下.锂电池广泛用于通信、电动车等行业,如图是锂的原子结构示意图和元素周期表中锂元素的部分信息,由此判断,锂原子在化学反应中易失去(选填“得到”或“失去”)电子,写出锂离子的符号Li+,氧化锂的化学式是Li2O.