题目内容
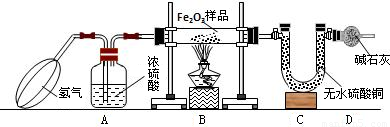
(2004?黄冈)阳光中学化学兴趣小组利用下图所示装置测定样品中Fe2O3(样品中杂质高温下不分解,也不参加反应)的质量分数,回答下列问题.
(1)实验开始时,应先挤压鼓气球持续一段时间,其目的是______.
(2)A装置的作用是______;实验前B装置中放入Fe2O3样品的操作是______;反应进行一段时间后C装置中的现象是______.
(3)反应前准确称量样品的质量为5g,完全反应后C装置增加了1.35g,则样品中Fe2O3的质量分数为______.
(4)若省去D装置,则实验所测定的样品中Fe2O3的质量分数比实际的质量分数会______(填“偏大”“偏小”或“不变”).
【答案】分析:(1)氢气具有可燃性,为防止爆炸,加热前应该先同氢气.排净试管内的空气;
(2)装置A中是浓硫酸作用是干燥气体,C中的无水硫酸铜检验水的生成;
(3)C中增加的质量是生成水的质量,由此可求出氧元素质量,进而求得Fe2O3的质量及质量分数.
(4)若省去D装置,C中质量会增大,所得结果变大.
解答:解:(1)因为氢气具有可燃性,装置内有空气时会发生爆炸.故答案为:除去装置中的空气,防止加热时发生爆炸;
(2)浓硫酸具有吸水性,A装置盛的是浓硫酸,作用是干燥氢气;由于该玻璃管两头通.装药品时应先使玻璃管平放,将盛有药品的药匙小心送入玻璃管中部(受热处);无水硫酸铜遇水变蓝,故答案为:白色粉末逐渐变蓝.
(3)因为C中增加的质量是生成水的质量1.35g,其中氧元素的质量是1.35g×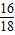 =1.2g,Fe2O3的质量1.2g÷
=1.2g,Fe2O3的质量1.2g÷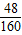 =4g,则样品中Fe2O3的质量分数为
=4g,则样品中Fe2O3的质量分数为 ×100%=80%,故答案为80%;
×100%=80%,故答案为80%;
(4)如果没有D装置,空气中的水蒸气会进入U形管,被无水硫酸铜所吸收,导致水的质量增大,结果使求得的样品中Fe2O3的质量分数比实际的偏大,故答案为偏大.
点评:该题通过一氧化碳还原氧化铁的实验考查样品中氧化铁的质量分数、操作步骤及误差分析,属于综合探究题.
(2)装置A中是浓硫酸作用是干燥气体,C中的无水硫酸铜检验水的生成;
(3)C中增加的质量是生成水的质量,由此可求出氧元素质量,进而求得Fe2O3的质量及质量分数.
(4)若省去D装置,C中质量会增大,所得结果变大.
解答:解:(1)因为氢气具有可燃性,装置内有空气时会发生爆炸.故答案为:除去装置中的空气,防止加热时发生爆炸;
(2)浓硫酸具有吸水性,A装置盛的是浓硫酸,作用是干燥氢气;由于该玻璃管两头通.装药品时应先使玻璃管平放,将盛有药品的药匙小心送入玻璃管中部(受热处);无水硫酸铜遇水变蓝,故答案为:白色粉末逐渐变蓝.
(3)因为C中增加的质量是生成水的质量1.35g,其中氧元素的质量是1.35g×
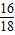 =1.2g,Fe2O3的质量1.2g÷
=1.2g,Fe2O3的质量1.2g÷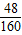 =4g,则样品中Fe2O3的质量分数为
=4g,则样品中Fe2O3的质量分数为 ×100%=80%,故答案为80%;
×100%=80%,故答案为80%;(4)如果没有D装置,空气中的水蒸气会进入U形管,被无水硫酸铜所吸收,导致水的质量增大,结果使求得的样品中Fe2O3的质量分数比实际的偏大,故答案为偏大.
点评:该题通过一氧化碳还原氧化铁的实验考查样品中氧化铁的质量分数、操作步骤及误差分析,属于综合探究题.

练习册系列答案
 考前必练系列答案
考前必练系列答案
相关题目