题目内容
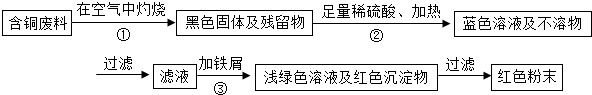
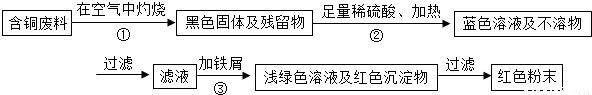
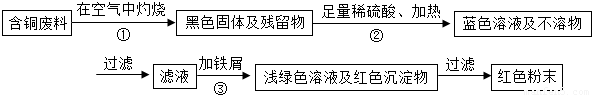
某集团是一家以生产电缆类产品为主的国家大型企业.在电缆生产过程中,不可避免地会产生一定量的含铜废料(如:零碎电缆).某化学兴趣小组的四位同学得知这一情况后,围绕“从含铜废料中回收铜”提出了各自的看法.甲同学根据已学知识,提出了一套回收方案:
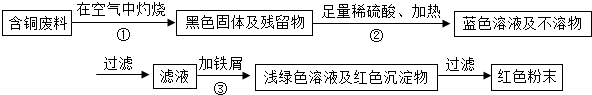
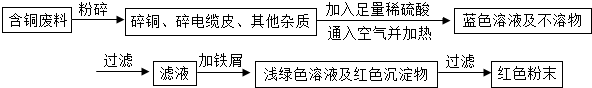
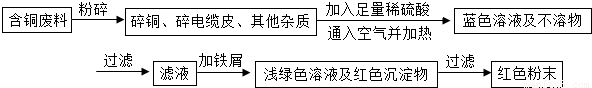
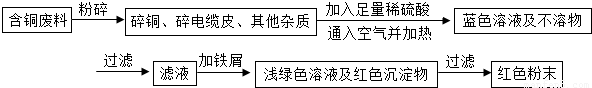
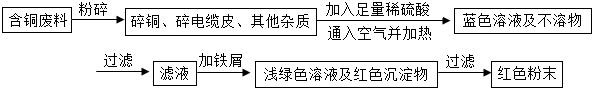
乙同学在查阅资料后得知:在通入空气并加热的条件下,铜可与稀硫酸在溶液中发生反应(方程式为:2Cu+2H2SO4+O2?2CuSO4+2H2O),于是他提出了另一套方案:
(1)甲方案的①、③两个步骤中,与铜或铜的化合物有关的化学反应方程式分别是:
①
(2)从环保角度对两套方案的不同部分进行比较,你认为
(3)丙认为,无论是甲还是乙的方案,在“加铁屑”这一步时,应该加入略过量的铁屑.你认为丙这么说的道理是:
丁又提出了疑问:“如果铁过量,剩余的铁粉会混在红色粉末中,该怎么处理呢?”.
请提出你的想法:
(4)最后,老师肯定了同学们的积极思考,但同时指出:方案最后一步所得浅绿色滤液结晶后,会得到一种俗称“绿矾”的工业产品,可增加经济效益.如果直接排放掉滤液,不仅造成了浪费,还会
(5)若上述方案所用的稀硫酸质量分数为36.8%,问每1000mL98%的浓硫酸(密度为1.84g/mL)能配制出这种稀硫酸
所以本题答案为:2Cu+O2
| ||
(2)采用灼烧含铜废料的方法能产生空气污染,所以本题答案为:乙,甲方案第一步“灼烧”会产生污染空气的气体、粉尘、烟雾;
(3)为确保硫酸铜中的铜全部被置换出来,需加入过量的铁粉,多余的铁粉可以利用铁与酸的反应除去,所以本题答案为:将Cu完全置换出来,将所得铜粉酸洗后再洗涤、干燥;
(4)硫酸亚铁排放到水中易造成水体污染,所以本题答案为:水污染或环境污染;
(5)1000mL98%的浓硫酸含溶质质量为1000mL×1.84g/mL×98%=1803.2g,所以能配出36.8%的硫酸质量为1803.2g÷36.8%=4900g,需水的质量为4900g-1000mL×1.84g/mL=3060g,故水的体积为
3060g÷1.0g/mL=3060mL,浓硫酸的密度比水大且溶于水时放出大量的热,稀释时要将浓硫酸倒入水中,所以本题答案为:4900,3060,将浓硫酸沿玻璃棒加入水中.

 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案某集团是一家以生产电缆类产品为主的国家大型企业。在电缆生产过程中,不可避免地会产生一定量的含铜废料(如:零碎电缆)。某化学兴趣小组的四位同学得知这一情况后,围绕“从含铜废料中回收铜”提出了各自的看法。
甲同学根据已学知识,提出了一套回收方案:
 |
![]() 乙同学在查阅资料后得知:在通入空气并加热的条件下,铜可与稀硫酸在溶液中发生反应(方程式为:2Cu + 2H2SO4 + O2 2CuSO4 + 2H2O),于是他提出了另一套方案:
乙同学在查阅资料后得知:在通入空气并加热的条件下,铜可与稀硫酸在溶液中发生反应(方程式为:2Cu + 2H2SO4 + O2 2CuSO4 + 2H2O),于是他提出了另一套方案:
 |
(1)甲方案的①②③三个步骤中,与铜或铜的化合物有关的化学反应方程式分别是:
① ;② ;
③ 。
(2)从环保角度对两套方案的不同部分进行比较,你认为 (填“甲”或“乙”)的方案更合理。理由是: 。
(3)丙认为,无论是甲还是乙的方案,在“加铁屑”这一步时,应该加入略过量的铁屑。你认为丙这么说的道理是: 。(2分)
丁又提出了疑问:“如果铁过量,剩余的铁会混在红色粉末中,该怎么处理呢?”。请提出你的想法: 。
(4)最后,老师肯定了同学们的积极思考,但同时指出:方案最后一步所得浅绿色滤液结晶后,会得到一种俗称“绿矾”的工业产品,可增加经济效益。请写出使“绿矾”结晶的两种可能方法: 、 (“绿矾”溶解度随温度升高而增大)。如果直接排放掉滤液,不仅造成了浪费,还会 。
(5)若上述方案所用的稀硫酸溶质质量分数为36.8%,问每1000mL98%的浓硫酸(密度为1.84g/mL)能配制出这种稀硫酸 g,需水 mL(水的密度为1.0g/mL)。在实验室中稀释浓硫酸时,是如何操作的: 。(2分)
![]() (6)根据乙同学查出的方程式(2Cu + 2H2SO4 + O2 2CuSO4 + 2H2O)计算:如果1000mL98%的浓硫酸(密度为1.84g/mL)稀释后全部参加了反应(假设硫酸不和碎电缆皮、其他杂质反应),所能处理的废料中含纯铜多少克?(请写出计算过程,结果精确到0.1克。5分)
(6)根据乙同学查出的方程式(2Cu + 2H2SO4 + O2 2CuSO4 + 2H2O)计算:如果1000mL98%的浓硫酸(密度为1.84g/mL)稀释后全部参加了反应(假设硫酸不和碎电缆皮、其他杂质反应),所能处理的废料中含纯铜多少克?(请写出计算过程,结果精确到0.1克。5分)