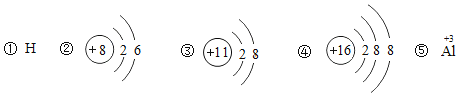题目内容
【题目】某钢厂实验室为测定赤铁矿中Fe2O3的含量,将矿石粉碎(其中杂质既不溶于水也不与酸反应)。进行如下实验:
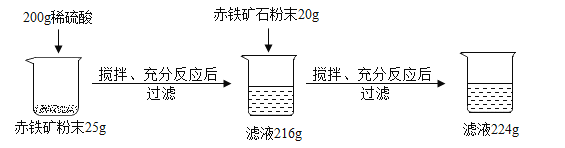
请回答下列问题:
(1)该赤铁矿石中Fe2O3的质量分数为__________。
(2)该锅厂用上述赤铁矿石1900吨来生产生铁,则理论上能生产杂质5%的生铁质量为多少吨____。
(3)求上述所用稀硫酸的溶质质量分数________。
【答案】64% 896t. 22.05%。
【解析】
(1)由题中信息可得,加入200g后,25g矿石中氧化铁完全反应,故25g矿石中杂质质量为25g+200g-216g=9g,故样品中氧化铁的质量分数为![]() ×100%=64% 。
×100%=64% 。
(2)由(1)可知,氧化铁的纯度为64%,故1900t中氧化铁质量=1900t×64%=1216t,氧化铁中铁元素质量分数=![]() ×100%=70%,故可生产纯铁质量=1216t×70%=851.2t,则生产杂质5%的生铁质量=851.2t÷95%=896t。
×100%=70%,故可生产纯铁质量=1216t×70%=851.2t,则生产杂质5%的生铁质量=851.2t÷95%=896t。
(3)最终滤液质量为224g,说明硫酸与24g氧化铁刚好完全反应,假设硫酸中溶质质量为x。
Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
160 3×98
24g x
![]() =
=![]() 解得x=44.1g,故稀硫酸的溶质质量分数=
解得x=44.1g,故稀硫酸的溶质质量分数=![]() ×100%=22.05% 。
×100%=22.05% 。

 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案【题目】下表是元素周期表的部分信息,请根据下表回答有关问题:
3 Li 锂 6.941 | 4 Be 铍 9.012 | 5 B 硼 10.81 | 6 C 碳 12.01 | 7 N 氮 14.01 | 8 O 氧 16.00 | 9 F 氟 19.00 | 10 Ne 氖 20.18 |
11 Na 钠 22.99 | 12 Mg 镁 24.31 | 13 Al 铝 26.98 | 14 Si 硅 28.09 | 15 P 磷 30.97 | 16 S 硫 32.06 | 17 Cl 氯 35.45 | 18 Ar 氩 39.95 |
(1)具有相似化学性质的一组元素是__________。(用2B铅笔将答题卡上对应题目的答案标号涂黑)
A.Na、Cl B.C、Be C.F、Cl D.Cl、Ar
(2)由第7号元素和第12号元素的原子形成化合物的化学式为__________。
(3)某粒子的结构示意图为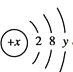 ,当
,当![]() 时,该粒子的符号为__________。
时,该粒子的符号为__________。
(4)钠、氯、氧三种元素可形成原子个数比为1:1:4的化合物,则此化合物中氯元素的化合价为__________。
(5)具有相同原子数和电子数的分子或离子叫等电子体。下列各组粒子中属于等电子体的是__________。(用2B铅笔将答题卡上对应题目的答案标号涂黑)
A.NO和O3 B.CO和N2 C.SO2和CO2 D.NH4+和H20+
【题目】现有铜与另一种金属的混合物粉末,另一种金属可能是镁、铁、锌中的一种,现欲测定其组成.取该混合物粉末8.0g放入烧杯中,将140.0g 14.0%的稀硫酸分四次加入该烧杯中,充分反应后,测得剩余固体质量数据记录如下:
次数 | 1 | 2 | 3 | 4 |
加入稀硫酸的质量/g | 35.0 | 35.0 | 35.0 | 35.0 |
剩余固体的质量/g | 6.8 | 5.6 | 4.4 | 4.2 |
求:
(1)该混合物粉末中铜的质量分数 ________ ;
(2)若参加反应的金属为R,请写出R与稀硫酸反应的化学方程式 ________ ;
(3)设金属R的相对原子质量为X,根据已知条件列出求解(X)的比例式 ________ ;
(4)如果将第三次加入硫酸充分反应后的溶液蒸发掉8.3g水,且无晶体析出,则所得溶液中溶质的质量分数为________ .