题目内容
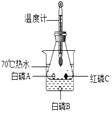
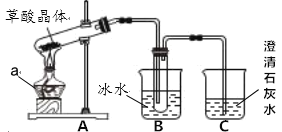
【题目】如图所示的实验装置可用来测定某气体X的组成,在注射器A中装有0.32g气体ⅹ并慢慢通过不含空气并装有足量灼热的氧化铜的玻璃管B,使气体X完全反应,得到以下实验结果:实验前B管重20.32g,实验后B管重20.00g,B管中出现红色粉末;C管中收集到的无色液体是水;注射器D中收集到生成的氮气0.28g,下列说法正确的是
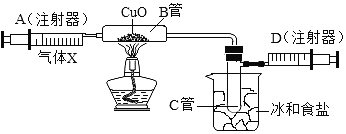
A. B管中发生的反应为置换反应
B. 气体Ⅹ中氮元素与氢元素的质量比为14:3
C. 该反应中生成的水与氮气的分子个数比为1:2
D. 气体X是N2H4
【答案】D
【解析】
根据气体与氧化铜反应生成铜、氮气和水来分析X的组成,氮气的质量就是气体中氮元素的质量,B管质量的减少量就是失去的氧元素的质量,根据氧化铜中氧元素质量可以计算出气体中氢元素质量,可以计算出水的质量,再计算水分子和氮分子的个数比.
A、X气体中含有氮元素、氢元素,所以一定不是单质,氧化铜属于化合物,所以B管中反应一定不是置换反应,故A错;
B、实验前B管重20.32克,实验后B管重20.00克,所以氧化铜中氧元素质量为0.32g,因为氧元素和氢元素结合生成水,所以氢元素质量为:0.04g,收集到生成的氮气0.28克,气体中氮元素质量为0.28g,所以氮元素与氢元素的质量比为0.28g:0.04g=7:1,故B错;
C、实验前B管重20.32克,实验后B管重20.00克,所以氧化铜中氧元素质量为0.32g,因为氧元素和氢元素结合生成水,所以氢元素质量为:0.04g,所以生成水的质量为:0.32g+0.04g=0.36g,该反应中生成的水与氮气的分子个数比为![]() ,故C错;
,故C错;
D、实验前B管重20.32克,实验后B管重20.00克,所以氧化铜中氧元素质量为0.32g,因为氧元素和氢元素结合生成水,所以氢元素质量为:0.04g,收集到生成的氮气0.28克,气体中氮元素质量为0.28g,所以氮元素与氢元素原子个数比为![]() :
:![]() =1:2,气体X是N2H4,故D正确;
=1:2,气体X是N2H4,故D正确;
故选D。

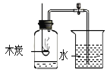
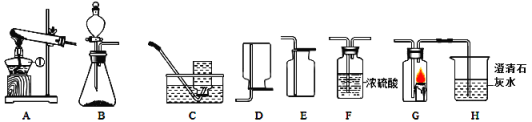
【题目】重庆一中化学兴趣小组用如图所示装置制取二氧化碳,并完成相关实验。
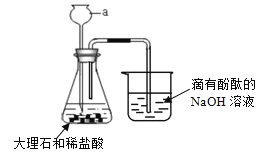
(1)仪器a的名称为_____________。
(2)锥形瓶中发生的化学反应方程式为___________________________________。
(3)待右侧烧杯中无气泡冒出后,同学们再次向锥形瓶中加入稀盐酸。由于加入稀盐酸过多,锥形瓶内液体沿导管进入右侧烧杯中。断开连接的导管,待其充分反应后,最终发现烧杯内的红色溶液变为无色溶液(不浑浊)。该溶液的溶质除酚酞外,还有什么?
猜想1:NaCl 猜想2:NaCl、CaCl2
猜想3:NaCl、HCl、CaCl2 猜想4:NaCl、Na2CO3
①经分析,甲同学认为不合理的猜想有_____________(填序号)。
②为验证其余猜想,乙同学做了以下实验:
实验内容 | 现象 | 结论 |
取样品少许于试管中,加入CaCO3粉末 | ________________________ | 猜想3成立 |
③丙同学认为还可以选择其它药品,也能得出猜想3成立的结论。他可以选择的药品有_____(填序号,下同)。
A.Cu(OH)2 B.NaOH C.Mg D.AgNO3
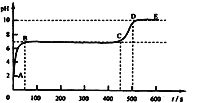
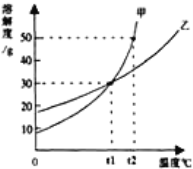
④根据猜想3成立,推测整个实验过程中,烧杯内溶液的pH随时间变化的图像正确的是___。(提示:氯化钙溶液呈中性)