题目内容
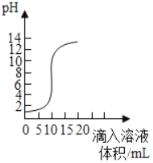
【题目】如图是利用数字化传感器得到的盐酸和氢氧化钙反应过程中溶液pH变化图象。
(1)在氢氧化钙溶液中滴入几滴无色酚酞,溶液呈_____色;然后滴加稀盐酸至恰好完全反应时,溶液的pH_____7(填“大于”、“小于”或“等于”)。该反应的化学方程式为_____;
(2)根据图中曲线判断,该反应是将_____(填“氢氧化钙溶液”或“盐酸”)滴入另一溶液中。
(3)当滴入溶液的体积为5mL时,所得溶液中的溶质为_____(填化学式),此时烧杯内溶液如果未经处理直接倒入铁制下水道,你认为可能造成的危害是_____(用化学方程式表示),要想处理烧杯内溶液使其只得到CaCl2溶液,应向溶液中加入过量_____,充分反应后过滤。
【答案】红 等于 Ca(OH)2+2HCl=CaCl2 +2H2O 氢氧化钙溶液 HCl和CaCl2 Fe+2HCl=FeCl2+H2↑ 碳酸钙
【解析】
(1)氢氧化钙溶液显碱性,在氢氧化钙溶液中滴入几滴无色酚酞,溶液呈红色;然后滴加稀盐酸至恰好完全反应时,溶液呈中性,溶液的pH等于7;氢氧化钙与稀盐酸反应生成氯化钙和水,反应的化学方程式为:Ca(OH)2+2HCl=CaCl2 +2H2O,故填:红;等于;Ca(OH)2+2HCl=CaCl2+2H2O;
(2)图象中pH值的变化是从小于7逐渐的增大到大于7,可知原溶液显酸性,然后不断的加入碱性溶液,使pH增大,说明是把氢氧化钙溶液滴加到稀盐酸中,故填:氢氧化钙溶液;
(3)当滴入溶液的体积为5mL时,溶液的pH小于7,溶液显酸性,说明稀盐酸过量,所得溶液中的溶质为HCl和CaCl2;
此时烧杯内溶液如果未经处理直接倒入铁制下水道,铁能与稀盐酸反应生成氯化亚铁溶液和氢气,反应的化学方程式为:Fe+2HCl=FeCl2+H2↑;
要想处理烧杯内溶液使其只得到CaCl2溶液,应向溶液中加入过量碳酸钙,碳酸钙与稀盐酸反应生成氯化钙、水和二氧化碳,充分反应后过滤除去过量的难溶于水的碳酸钙即可,故填:HCl和CaCl2; Fe+2HCl=FeCl2+H2↑;碳酸钙。