题目内容
【题目】图是甲、乙两种固休物质的溶解度曲线。下列说法错误的是

A. t1℃时,25g甲充分溶解于100g水中,配得甲的饱和溶液
B. 若甲中含有少量乙,可用溶解、过滤的方法提纯甲
C. 将甲的饱和溶液从t2℃降温到t1℃,可析出晶体
D. t2℃时,甲、乙饱和溶液的溶质质量分数相等
【答案】B
【解析】
A、根据甲的溶解度曲线可知t1℃时,甲的溶解度为25g,即25g甲充分溶解于100g水中,配得甲的饱和溶液,故不符合题意;
B、甲的溶解度受温度影响比较大,且随温度的升高逐渐增大,乙的溶解度随温度升高变化不大,可以用降温结晶的方法提纯甲,故符合题意;
C、根据溶解度曲线可知,将甲的饱和溶液从t2℃降温到t1℃,可析出晶体,故不符合题意;
D、t2℃时,甲乙物质的溶解度相等,所以这个温度下甲、乙饱和溶液的溶质质量分数相等,故不符合题意。

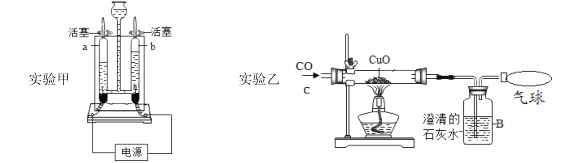
【题目】某研究小组用如图所示装置,探究能否用镁条代替红磷测定空气中氧气含量。

(提出猜想)
猜想1:可以代替,因为镁条与氧气反应后不会产生气体
猜想2:不能代替,因为镁条可能会与空气中的其他成分发生反应
(进行实验)
步骤 | 实验操作 | 实验现象 |
Ⅰ | 组装好装置后,打开止水夹,手捂集气瓶,一段时间后,松开手 | 烧杯中导管口有气泡冒出,松手后,烧杯中导管末端有一段液柱 |
Ⅱ | 关闭止水夹,点燃镁条,迅速伸入集气瓶中,塞好塞子 | 镁条燃烧,放出大量热,发出耀眼白光,生成大量白烟,剩余固体为白色带状物还夹杂着极少量淡黄色的固体 |
Ⅲ | 冷却至室温,打开止水夹 | 烧杯中水从导管进入集气瓶中,体积约为集气瓶体积的 |
(解释与结论)
(1)步骤Ⅰ的实验目的是_____。
(2)步骤Ⅱ中,关闭止水夹的目的是_____。
(3)根据实验现象中的_____(写一个即可)可以推测猜想2成立。
①(继续探究)经查阅资料得知氮化镁(Mg3N2)为淡黄色的固体,于是小晴猜想镁条还可能会与空气中的_____发生反应;
②(设计实验)她设计实验方案证明自己的猜想_____;
③(实验结论)镁条与氮气反应的化学方程式为:_____;
④(反思与评价)通过上述探究活动,你对燃烧有什么新的认识?_____。