题目内容
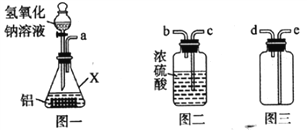
【题目】为了测定黄铜样品(假设只含铜和锌)中铜的质量分数,某化学小组进行了如下实验:

(1)配制上述质量分数为19.6%的稀硫酸,需要质量分数为98%的浓硫酸的质量是__g;
(2)发生反应的化学方程式为_________________________________;
(3)根据已知条件列出求解50g该黄铜样品中锌的质量(x)的比例式为________;
(4)该黄铜样品中铜的质量分数为______________;
(5) 向滤液中加入209.4g水后,则最终所得溶液中溶质的质量分数为_________。
【答案】 20 Zn+H2SO4==ZnSO4+H2↑ 65/98=x/19.6g 74% 10%
【解析】根据所学知识和题中信息知,(1)配制上述质量分数为19.6%的稀硫酸,需要质量分数为98%的浓硫酸的质量是100g×19.6%÷98%=20g;(2)发生反应的化学方程式为Zn+H2SO4==ZnSO4+H2↑;
(3)Zn+H2SO4 == ZnSO4+H2↑ 50g该黄铜样品中锌的质量(x)的比例式为65/98=x/19.6g.
65 98 161 2
X 100g×19.6% y z 65/98=x/19.6g. x=13g, 98/161=100g×19.6%/y.,y=32.2g.
98/2=100g×19.6%/z,z=0.4g.
(4)该黄铜样品中铜的质量分数为![]() ×100%=74%.
×100%=74%.
(5)向滤液中加入209.4g水后,则最终所得溶液中溶质的质量分数为![]() ×100%=10%.
×100%=10%.
点睛∶本题主要考查质量守恒定律的应用以及根据化学方程式进行计算。

练习册系列答案
相关题目