题目内容
【题目】空气中氧气含量测定的再认识. 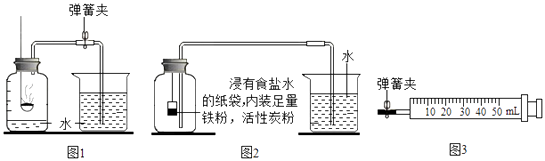
(1)【实验回顾】如图1是实验室用红磷燃烧来粗略测定空气中氧气含量的装置. ①用弹簧夹夹紧橡皮管.
②点燃燃烧匙内的红磷,立即伸入瓶中并塞紧塞子.
③ .
④观察并记录水面的变化情况.
【实验反思】多次实验,反向集气瓶内上升的水的体积始终小于瓶内原空气体积的 ![]() .
.
(2)【实验改进1】 I.根据铁在空气中生锈的原理(铁与氧气和水发生反应生成铁锈)设计图2实验装置,再次测定空气中氧气含量.装置中的食盐水和活性炭会加速铁生锈.
II.测得实验数据如下表
测量项目 | 实验前 | 实验后 | |
烧杯中水的体积 | 烧杯中剩余水的体积 | 集气瓶(扣除内容物)和导管的容积 | |
体积/mL | 80.0 | 54.5 | 126.0 |
【交流表达】
(i)铁生锈过程发生复杂的化学反应,首先是铁与氧气、水反应生成氢氧化亚铁,写出该反应的化学方程式 , 基本反应类型是 .
(ii)根据表数据计算,改进实验后测得的空气中氧气的体积分数是 . (消耗的水的体积忽略不计,计算结果保留一位小数).
(3)【猜想与假设】根据铁生锈的原理,某同学对最终生成的铁锈的好主意成分作出猜想:(Ⅰ)氧化铁(Ⅱ)碳酸铁,你认为猜想(填序号)一定是错误的,理由是 .
(4)【实验改进2】实验如图3装置进行实验.实验前应先进行的操作是检查装置的气密性
(5)【实验过程】 步骤1:在注射器放入装有足量铁粉、活性炭粉的浸有食盐水的纸袋,封闭.
步骤2:打开弹簧夹,将活塞向右拉至一定距离,关闭弹簧夹.
步骤3:不断轻轻晃动注射器,至活塞位置不再发生变化.
【数据处理】实验中需要记录的数据是 .
计算得出氧气约占空气总体积的 ![]() .
.
(6)【实验评价】与燃烧红磷法相比,用改进实验测定空气中氧气含量的优点是
【答案】
(1)待装置冷却后打开弹簧夹
(2)2Fe+2H2O+O2=2Fe(OH)2;化合反应;20.2%
(3)(Ⅱ);化学反应前后元素种类不变
(4)检查装置的气密性
(5)注射器中原来的空气体积,反应后剩余气体的体积
(6)铁的缓慢氧化使集气瓶中的氧气消耗更为彻底,使实验结果更准确;测量时考虑到导管容积和扣除内容物后的集气瓶容积,使实验结果更准确
【解析】解:【实验回顾】等待实验装置温度冷却至室温后,再打开弹簧夹,故填:待装置冷却后打开弹簧夹.【交流表达】(i)铁与氧气、水反应生成氢氧化亚铁[Fe(OH)2],该反应的化学方程式为:2Fe+2H2O+O2=2Fe(OH)2;基本反应类型是化合反应;(ii)根据反应前后烧杯内水的体积变化可以看出,消耗的氧气的体积是:80﹣54.5=25.5mL,故氧气的体积分数为 ![]() ×100%≈20.2%,故填:20.2%; 【猜想与假设】根据质量守恒定律可知,反应前后元素的种类不变,反应物中没有碳元素,所以不能可能是碳酸铁.
×100%≈20.2%,故填:20.2%; 【猜想与假设】根据质量守恒定律可知,反应前后元素的种类不变,反应物中没有碳元素,所以不能可能是碳酸铁.
故填:(Ⅱ);化学反应前后元素种类不变.
【实验改进2】对于有气体参与或生成的反应,实验前一定要检查装置的气密性,故填:检查装置的气密性.
【数据处理】要用此方法来测定空气中氧气的含量,就需要记录反应前后注射器内气体的体积,故填:注射器中原来的空气体积,反应后剩余气体的体积.
【实验评价】使用铁的缓慢氧化消耗氧气,使氧气消耗的更为彻底,实验结果更准确,测量时考虑导管容积和扣除内容物后的集气瓶的体积,使实验结果更为准确.
所以答案是:【实验回顾】待装置冷却后打开弹簧夹;【交流表达】(i)2Fe+2H2O+O2=2Fe(OH)2;化合反应;(ii)20.2%;【猜想与假设】(Ⅱ);化学反应前后元素种类不变.
【实验改进2】检查装置的气密性;
【数据处理】注射器中原来的空气体积,反应后剩余气体的体积.
【实验评价】铁的缓慢氧化使集气瓶中的氧气消耗更为彻底,使实验结果更准确;测量时考虑到导管容积和扣除内容物后的集气瓶容积,使实验结果更准确.
【考点精析】解答此题的关键在于理解书写化学方程式、文字表达式、电离方程式的相关知识,掌握注意:a、配平 b、条件 c、箭号.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案