题目内容
于水,也不与稀硫酸反应),充分反应后,称得烧杯内物质的总质量为64.6g。试计算:
(1)生成氢气的体积。(精确到0.1L,在标准状况下氢气的密度为0.9g/L)
(2)锌粒中所含锌的质量分数(精确到0.1%)。
解:根据质量守恒定律,生成氢气的质量=15.0g+50.0g-64.6g=0.4g……… (1分)
氢气的体积为:0.4g÷0.09g/L=4.4L……… (1分)
设锌粒中含锌的质量为x 。
Zn + H2SO4 = ZnSO4 + H2↑……(1分)
65 2
x 0.4g ……(1分)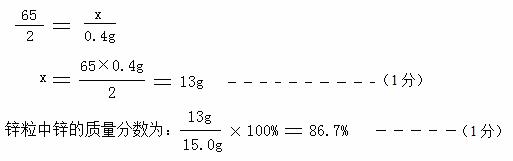
答:生成氢气的体积为4.4L,锌粒中锌的质量分数为86.7%。
(说明:设答没有设分,但不能正确的设答扣0.5分)

练习册系列答案
 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案
相关题目
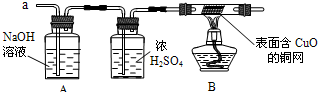
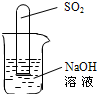
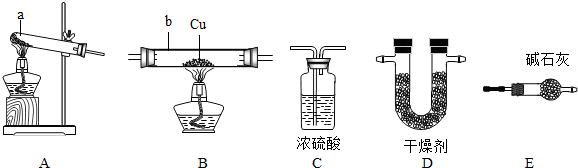
 NH3↑+CO2↑+H2O;②2NH3+H2SO4=(NH4)2SO4;③2NH3+3CuO
NH3↑+CO2↑+H2O;②2NH3+H2SO4=(NH4)2SO4;③2NH3+3CuO