题目内容
18、请你参与下列探究:
【问题情景】某化学实验小组同学将铁粉投入硫酸铜溶液中,发现生成红色固体物质的同时有较多的气泡放出.这一现象激发起同学们的探究欲望,生成的是什么气体?
【提出猜想】从物质组成元素的角度,放出的气体可能是SO2、O2、H2.
【查阅资料】SO2易溶于水,它能与NaOH反应,生成Na2SO3.
【方案设计】依据上述猜想,实验小组同学分别设计了如下方案:
(1)甲同学认为是O2,则检验方法是
(2)乙同学认为是SO2,则只需将放出的气体通入盛有NaOH溶液的洗气瓶中,称量通气前后洗气瓶的质量.写出SO2与NaOH反应的化学方程式
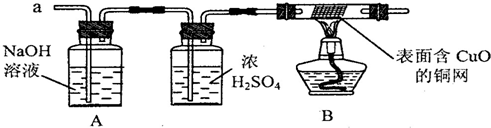
(3)实验小组同学合作设计了如下组合实验方案,排除和验证猜想的气体.
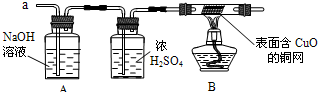
如果放出的是O2和H2,你认为方案中的安全隐患是
丙同学认为:为确保安全,实验前应先收集一试管气体,用拇指
【实验探究】经丙同学确认安全后,小组同学首先对装置A进行称量,再将收集到的气体从a通入,过一会儿点燃B处酒精灯;一段时间后,发现表面含CuO的铜网由黑色变为光亮的红色;停止通气,再次称量装置A,发现质量无增减.
结论:铁粉与硫酸铜溶液反应时,产生的气体是
【思维拓展】
(1)由上述实验可以推出,硫酸铜溶液中可能含有
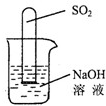
(2)不通过称量,如何判断SO2与NaOH溶液发生了反应呢?有一同学设计了右图所示的装置进行实验,发现试管内液面上升,就得出SO2与NaOH溶液发生反应的结论.其他同学认为这一方案不严谨,理由是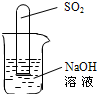
CuSO4溶液对过氧化氢的分解具有催化作用.有同学想猜想其他盐溶液也能在这个反应中起到同样的作用,于是他们做了以下的探究:
(1)清你帮助他们完成实验报告:
(2)已知FeCl3在水中可分离出Fe3+和Cl-,同学们提出以下猜想:
①甲同学的猜想:真正催化分解H2O2的是FeCl3溶液中的H2O;
②乙同学的猜想:真正催化分解H2O2的是FeCl3溶液中的Fe3+;
③丙同学的猜想:真正催华分解 H2O2的是FeCl3溶液中的Cl-;
你认为最不可能的是
(3)同学们对余下的两个猜想,用实验进行了探究.请你仔细分析后填表:
用18mol/L的硫酸配置100ml 1.0mol/L的稀硫酸,若实验仪器有:
A.100ml量筒 B.托盘天平 C.玻璃棒 D.50ml容量瓶
E.10ml量筒 F.胶头滴管 G.50ml烧杯 H.100ml容量瓶
(1)实验时应选用仪器的先后顺序是(填入编号)
(2)在容量瓶的使用方法中,下列操作不正确的是(填写编号)
A.使用容量瓶前检查它是否漏水
B.容量瓶用蒸馏水洗净后,再用待配溶液润洗
C.配置溶液时,如果试样是固体,把称好的试样用纸条小心倒入容量瓶中,缓慢加入蒸馏水到接近标线1cm-2cm处,用滴管滴加蒸馏水到标线.
D.配置溶液时,如果试样是液体,用量筒量取后直接倒入容量瓶中,缓慢加入蒸馏水到接近标线1cm-2cm处,用滴管加入蒸馏水到标线.
E.盖好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转和摇动多次.
【问题情景】某化学实验小组同学将铁粉投入硫酸铜溶液中,发现生成红色固体物质的同时有较多的气泡放出.这一现象激发起同学们的探究欲望,生成的是什么气体?
【提出猜想】从物质组成元素的角度,放出的气体可能是SO2、O2、H2.
【查阅资料】SO2易溶于水,它能与NaOH反应,生成Na2SO3.
【方案设计】依据上述猜想,实验小组同学分别设计了如下方案:
(1)甲同学认为是O2,则检验方法是
用带火星的木条试验,看木条是否复燃
.(2)乙同学认为是SO2,则只需将放出的气体通入盛有NaOH溶液的洗气瓶中,称量通气前后洗气瓶的质量.写出SO2与NaOH反应的化学方程式
SO2+2NaOH=Na2SO3+H2O
.(3)实验小组同学合作设计了如下组合实验方案,排除和验证猜想的气体.

如果放出的是O2和H2,你认为方案中的安全隐患是
实验时剩余气体B通过加热的试管易发生爆炸事故
.丙同学认为:为确保安全,实验前应先收集一试管气体,用拇指
堵住试管囗,靠近火焰点火,
,若不发出尖锐的爆鸣声
,方可采用上面的装置进行实验.【实验探究】经丙同学确认安全后,小组同学首先对装置A进行称量,再将收集到的气体从a通入,过一会儿点燃B处酒精灯;一段时间后,发现表面含CuO的铜网由黑色变为光亮的红色;停止通气,再次称量装置A,发现质量无增减.
结论:铁粉与硫酸铜溶液反应时,产生的气体是
H2
.【思维拓展】
(1)由上述实验可以推出,硫酸铜溶液中可能含有
H2SO4
物质.(2)不通过称量,如何判断SO2与NaOH溶液发生了反应呢?有一同学设计了右图所示的装置进行实验,发现试管内液面上升,就得出SO2与NaOH溶液发生反应的结论.其他同学认为这一方案不严谨,理由是

SO2溶于水中也会导致试管内气压减小,液面上升
.要得到科学严谨的结论,仍利用该装置,补做的实验是把烧杯中的氢氧化钠换成硫酸钠溶液,做一个对比试验
.CuSO4溶液对过氧化氢的分解具有催化作用.有同学想猜想其他盐溶液也能在这个反应中起到同样的作用,于是他们做了以下的探究:
(1)清你帮助他们完成实验报告:
| 实验过程 | 实验现象 | 实验结论 |
| 在一支试管中加入5ml5%的H2O2溶液,然后滴入适量的FeCl3溶液,把带火星的木条伸入试管. | 试管中有大量的气泡产生,伸入的带火星的木条复燃 |
FeCl3溶液可以催化分解H2O2 |
①甲同学的猜想:真正催化分解H2O2的是FeCl3溶液中的H2O;
②乙同学的猜想:真正催化分解H2O2的是FeCl3溶液中的Fe3+;
③丙同学的猜想:真正催华分解 H2O2的是FeCl3溶液中的Cl-;
你认为最不可能的是
甲
同学的猜想,理由是因过氧化氢溶液中自身有水,可见水不是催化剂
.(3)同学们对余下的两个猜想,用实验进行了探究.请你仔细分析后填表:
| 实验过程 | 实验现象 | 实验结论 |
| 向盛有5ml5%的H2O2溶液的试管中加入少量的HCl,并把带火星的木条伸入试管 | 无明显现象 | 起催化作用的不是Cl- |
| 向盛有5ml5%的H2O2溶液的试管中加入少量的 Fe(NO3)3溶液 ,并把带火星的木条伸入试管 |
试管中有大量气泡产生,带火星的木条复燃 |
起催化作用的是Fe3+ |
A.100ml量筒 B.托盘天平 C.玻璃棒 D.50ml容量瓶
E.10ml量筒 F.胶头滴管 G.50ml烧杯 H.100ml容量瓶
(1)实验时应选用仪器的先后顺序是(填入编号)
F、E、G、C、H
.(2)在容量瓶的使用方法中,下列操作不正确的是(填写编号)
B、C、D
.A.使用容量瓶前检查它是否漏水
B.容量瓶用蒸馏水洗净后,再用待配溶液润洗
C.配置溶液时,如果试样是固体,把称好的试样用纸条小心倒入容量瓶中,缓慢加入蒸馏水到接近标线1cm-2cm处,用滴管滴加蒸馏水到标线.
D.配置溶液时,如果试样是液体,用量筒量取后直接倒入容量瓶中,缓慢加入蒸馏水到接近标线1cm-2cm处,用滴管加入蒸馏水到标线.
E.盖好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转和摇动多次.
分析:方案设计:(1)根据氧气的助燃性来检验;(2)根据方程式的书写方法来考虑;(3)根据氧气和氢气的性质和氢气的验纯方法考虑.结论:通过前面的实验进行排除即可;
思维拓展:(1)要想产生氢气要考虑金属与酸反应;(2)根据二氧化硫的性质考虑;只要是不与二氧化硫反应的溶液就行,主要是对比实验.
(1)根据催化剂的作用,若FeCl3溶液能催化H2O2分解,加入FeCl3溶液,应可观察到试管中产生大量气泡,伸入试管中的带火星木条复燃;
(2)催化剂在反应前后质量和化学质量都不变,根据催化剂的这一特点,判断过氧化氢溶液中水、FeCl3溶液中的
Fe3+、Cl-是否可以催化过氧化氢的分解;
(3)为检验两种离子中哪一种离子对过氧化氢分解起到了催化作用,可采取控制变量的方法进行实验探究,即加入其它含Fe3+或Cl-的溶液进行对比;
(1)根据浓硫酸稀释的步骤推出需要的仪器;
(2)根据会造成误差的原因进行分析.
思维拓展:(1)要想产生氢气要考虑金属与酸反应;(2)根据二氧化硫的性质考虑;只要是不与二氧化硫反应的溶液就行,主要是对比实验.
(1)根据催化剂的作用,若FeCl3溶液能催化H2O2分解,加入FeCl3溶液,应可观察到试管中产生大量气泡,伸入试管中的带火星木条复燃;
(2)催化剂在反应前后质量和化学质量都不变,根据催化剂的这一特点,判断过氧化氢溶液中水、FeCl3溶液中的
Fe3+、Cl-是否可以催化过氧化氢的分解;
(3)为检验两种离子中哪一种离子对过氧化氢分解起到了催化作用,可采取控制变量的方法进行实验探究,即加入其它含Fe3+或Cl-的溶液进行对比;
(1)根据浓硫酸稀释的步骤推出需要的仪器;
(2)根据会造成误差的原因进行分析.
解答:解:方案设计:(1)由于氧气具有助燃性能使带火星的木条复燃,所以用带火星的木条检验,看是否复燃;
(2)SO2与NaOH反应的反应物是SO2和NaOH,生成物是亚硫酸钠和水,再通过观察法进行配平即可;
(3)氢气具有可燃性,如若不纯,点燃或加热时易产生爆炸事故,所以使用前要注意验纯,一般采用小试管收集点燃的方法,不纯时能发出尖锐的爆鸣声;
结论:通过氢氧化钠溶液,氢氧化钠溶液的质量没有改变说明不是二氧化硫,表面含CuO的铜网由黑色变为光亮的红色,说明氧化铜被还原为铜,故产生说明该气体为氢气;
【思维拓展】(1)要想产生氢气必须是金属与酸反应,所以硫酸铜溶液中可能含有硫酸;
(2)由于SO2溶于水中能与水反应生成亚硫酸,也会导致试管内气压减小,使液面上升,因此要做一个对比试验即可,把烧杯中的氢氧化钠换成硫酸钠溶液,做一个对比试验;
(1)根据实验结论可得知FeCl3溶液能催化H2O2分解,因此,向5%的过氧化氢溶液加入FeCl3溶液时,可以观察到:试管中有大量的气泡产生,伸入的带火星的木条复燃;
故答案为:试管中有大量的气泡产生,带火星的木条复燃;
(2)5%的过氧化氢溶液中含有大量的水,但分解速率依然很小,说明溶液中的水并不能催化过氧化氢的分解,而且过氧化氢分解生成水和氧气,使之在变化前后溶液中水的质量发生了改变;从以上两个方面都可以说明水不能作用过氧化氢分解的催化剂,故猜想甲明显不对;
故答案为:甲;因过氧化氢溶液中自身有水,可见水不是催化剂;
(3)为检验Cl-向过氧化氢溶液中加入了含有Cl-的稀盐酸,观察到无明显改变,说明溶液中的Cl-不能对过氧化氢分解起到催化作用;因此,可推测溶液中的Fe3+催化了过氧化氢的分解,因此另一个探究实验应加入含有Fe3+的溶液进行,并应观察到产生大量气体和带火星木条的复燃;故可加入含Fe3+的硫酸铁溶液或硝酸铁溶液;
(1)配置一定物质的量浓度的溶液,一般要经过计算、量取(使用量筒量取、胶头滴管)、稀释(在烧杯中稀释、玻璃棒搅拌均匀)、装瓶(容量瓶)存放;用18mol/L硫酸配制1.0mol/L硫酸,实际是稀释问题的计算及物质的量浓度溶液配制实验操作,根据稀释定律C1V1=C2V2可计算18mol/L硫酸的体积=5.6mL,该体积的液体用10mL量筒量取比用100mL量筒量取误差要小,故应选E,而不选A;所以配制溶液需要用到的仪器有:胶头滴管、10mL量筒、烧杯、玻璃棒、100mL容量瓶;
(2)主要涉及的是容量瓶的使用方法.用待配溶液润洗容量瓶,这样会使内壁附着溶质,导致所配溶液浓度偏大,B不正确;若在容量瓶中进行溶解或稀释,由于热效应会使溶液的体积和容量瓶的容量发生改变,所配溶液浓度有误差,C、D不正确.
故答案为:
【方案设计】(1)将带火星的木条放入瓶中,木条不复燃;
(2)SO2+2NaOH═Na2SO3+H2O;
(3)混合气体在B中易被点燃,发生爆炸;尖锐的爆鸣声;结论:H2;
【思维拓展】(1)H2SO4或HCl;
(2)SO2溶于水中也会导致试管内气压减小,液面上升;把烧杯中的氢氧化钠换成硫酸钠溶液,做一个对比试验;
(1)试管中有大量的气泡产生,伸入的带火星的木条复燃;
(2)甲,因过氧化氢溶液中自身有水,可见水不是催化剂;
(3)
(1)F、E、G、C、H;
(2)B、C、D.
(2)SO2与NaOH反应的反应物是SO2和NaOH,生成物是亚硫酸钠和水,再通过观察法进行配平即可;
(3)氢气具有可燃性,如若不纯,点燃或加热时易产生爆炸事故,所以使用前要注意验纯,一般采用小试管收集点燃的方法,不纯时能发出尖锐的爆鸣声;
结论:通过氢氧化钠溶液,氢氧化钠溶液的质量没有改变说明不是二氧化硫,表面含CuO的铜网由黑色变为光亮的红色,说明氧化铜被还原为铜,故产生说明该气体为氢气;
【思维拓展】(1)要想产生氢气必须是金属与酸反应,所以硫酸铜溶液中可能含有硫酸;
(2)由于SO2溶于水中能与水反应生成亚硫酸,也会导致试管内气压减小,使液面上升,因此要做一个对比试验即可,把烧杯中的氢氧化钠换成硫酸钠溶液,做一个对比试验;
(1)根据实验结论可得知FeCl3溶液能催化H2O2分解,因此,向5%的过氧化氢溶液加入FeCl3溶液时,可以观察到:试管中有大量的气泡产生,伸入的带火星的木条复燃;
故答案为:试管中有大量的气泡产生,带火星的木条复燃;
(2)5%的过氧化氢溶液中含有大量的水,但分解速率依然很小,说明溶液中的水并不能催化过氧化氢的分解,而且过氧化氢分解生成水和氧气,使之在变化前后溶液中水的质量发生了改变;从以上两个方面都可以说明水不能作用过氧化氢分解的催化剂,故猜想甲明显不对;
故答案为:甲;因过氧化氢溶液中自身有水,可见水不是催化剂;
(3)为检验Cl-向过氧化氢溶液中加入了含有Cl-的稀盐酸,观察到无明显改变,说明溶液中的Cl-不能对过氧化氢分解起到催化作用;因此,可推测溶液中的Fe3+催化了过氧化氢的分解,因此另一个探究实验应加入含有Fe3+的溶液进行,并应观察到产生大量气体和带火星木条的复燃;故可加入含Fe3+的硫酸铁溶液或硝酸铁溶液;
| 实验步骤 | 实验现象 | 结论 |
| 起催化作用的不是Cl- | ||
| Fe(NO3)3溶液 | 试管中有大量气泡产生,带火星的木条复燃 | 起催化作用的是Fe3+ |
(2)主要涉及的是容量瓶的使用方法.用待配溶液润洗容量瓶,这样会使内壁附着溶质,导致所配溶液浓度偏大,B不正确;若在容量瓶中进行溶解或稀释,由于热效应会使溶液的体积和容量瓶的容量发生改变,所配溶液浓度有误差,C、D不正确.
故答案为:
【方案设计】(1)将带火星的木条放入瓶中,木条不复燃;
(2)SO2+2NaOH═Na2SO3+H2O;
(3)混合气体在B中易被点燃,发生爆炸;尖锐的爆鸣声;结论:H2;
【思维拓展】(1)H2SO4或HCl;
(2)SO2溶于水中也会导致试管内气压减小,液面上升;把烧杯中的氢氧化钠换成硫酸钠溶液,做一个对比试验;
(1)试管中有大量的气泡产生,伸入的带火星的木条复燃;
(2)甲,因过氧化氢溶液中自身有水,可见水不是催化剂;
(3)
| 实验步骤 | 实验现象 | 结论 |
| 起催化作用的不是Cl- | ||
| Fe(NO3)3溶液 | 试管中有大量气泡产生,带火星的木条复燃 | 起催化作用的是Fe3+ |
(2)B、C、D.
点评:判断两种物质反应后生成物是什么气体时,要根据质量守恒定律来做出推断,再进行逐一排除,催化剂可以改变反应的速率但不会改变反应的结果,催化剂在反应前后其质量和化学性质都不变;一定物质的量浓度溶液的配置、有关溶液稀释的简单计算.配制一定物质的量浓度溶液,是中考对这部分知识考查的又一热点,操作步骤、实验仪器、配制方案的设计、实验过程中的误差分析,都将是考查的重点.

练习册系列答案
相关题目
 23、请你参与下列探究:
23、请你参与下列探究: