题目内容
海洋是个巨大的资源宝库,它不仅孕育着无数的生命,还含有大量的化学物质.海水经过晒盐后得到粗盐和苦卤,提纯后的食盐中还含有硫酸钠、氯化镁、氯化钙等可溶性杂质,他们在溶液中主要以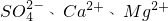 的形式存在,为将这些杂质离子除净,应加入过量的氯化钡、氢氧化钠、碳酸钠等物质将其转化为沉淀,过滤除去;再加入适量的盐酸,得到精盐水,最后经蒸发即得精盐.以下是某化工厂对海水进行综合利用的示意图1:
的形式存在,为将这些杂质离子除净,应加入过量的氯化钡、氢氧化钠、碳酸钠等物质将其转化为沉淀,过滤除去;再加入适量的盐酸,得到精盐水,最后经蒸发即得精盐.以下是某化工厂对海水进行综合利用的示意图1:

(1)在粗盐提纯的实验中,主要操作步骤是________、________、蒸发.蒸发过程中玻璃棒的作用是________.
(2)在利用粗盐制备精盐过程的第⑥步操作中,加入适量盐酸的目的是________.
(3)在制备精盐的过程中,氯化钡和碳酸钠溶液的添加顺序是否可以颠倒________,理由是________.
(4)长岛的海水淡化采用的方法是膜法,如图2所示,对淡化膜右侧的海水加压,水分子可以透过淡化膜进入左侧淡水池,而海水中的各种离子不能通过淡化膜,从而得到淡水,对加压后右侧海水成分变化进行分析,正确的是________(填序号).

①溶质质量增加 ②溶液质量不变 ③溶剂质量减少 ④溶质质量分数不变,
通过对上述膜法淡化海水的原理的分析,你认为它与过滤有哪些相似之处________.
解:(1)粗盐提纯步骤为:溶解→过滤→蒸发结晶;蒸发时玻璃棒不断搅拌是为了受热均匀,防止局部受热造成液体飞溅,故(1)答案:溶解、过滤,防止局部受热造成液体飞溅.
(2)在提纯的过程中氢氧化钠和碳酸钠都要过量,氢氧化钠和盐酸反应生成氯化钠和水,碳酸钠和盐酸反应生成氯化钠、水和二氧化碳,故(2)答案:除去过量的碳酸钠和氢氧化钠.
(3)碳酸钠和氯化钡反应生成碳酸钡沉淀和氯化钠,还能和钙离子结合成碳酸钙沉淀,故碳酸钠作用是既除去Ca2+,又除去多余的氯化钡所以不能颠倒,故(3)答案:不可以,碳酸钠作用是既除去Ca2+,又除去多余的氯化钡.
(4)对淡化膜右侧的海水加压,水分子可以透过淡化膜进入左侧淡水池,而海水中的各种离子不能通过淡化膜,从而得到淡水,所以右侧海水中的溶剂水减少了;过滤和淡化膜技术都是为了分离混合物,运用了筛选的思想,但膜的孔径大小不同.故(4)答案:膜法淡化海水和过滤在道理上是相似的,都是利用了筛选的思想,只是膜的孔径大小不同罢了.
分析:(1)粗盐提纯步骤为:溶解→过滤→蒸发结晶;
(2)运用盐酸能和氢氧化钠反应、还能和碳酸钠反应的性质解答;
(3)运用碳酸钠即为了除去钙离子也为了除去氯化钡解答;
(4)运用对淡化膜右侧的海水加压,水分子可以透过淡化膜进入左侧淡水池,而海水中的各种离子不能通过淡化膜,从而得到淡水这一信息和过滤、淡化膜的区别和共同点解答解答.
点评:熟记过滤方法及原理、蒸发的操作的要求、盐酸的性质、碳酸钠的性质,会判断复分解反应发生的条件并熟练书写出相应的生成物.
(2)在提纯的过程中氢氧化钠和碳酸钠都要过量,氢氧化钠和盐酸反应生成氯化钠和水,碳酸钠和盐酸反应生成氯化钠、水和二氧化碳,故(2)答案:除去过量的碳酸钠和氢氧化钠.
(3)碳酸钠和氯化钡反应生成碳酸钡沉淀和氯化钠,还能和钙离子结合成碳酸钙沉淀,故碳酸钠作用是既除去Ca2+,又除去多余的氯化钡所以不能颠倒,故(3)答案:不可以,碳酸钠作用是既除去Ca2+,又除去多余的氯化钡.
(4)对淡化膜右侧的海水加压,水分子可以透过淡化膜进入左侧淡水池,而海水中的各种离子不能通过淡化膜,从而得到淡水,所以右侧海水中的溶剂水减少了;过滤和淡化膜技术都是为了分离混合物,运用了筛选的思想,但膜的孔径大小不同.故(4)答案:膜法淡化海水和过滤在道理上是相似的,都是利用了筛选的思想,只是膜的孔径大小不同罢了.
分析:(1)粗盐提纯步骤为:溶解→过滤→蒸发结晶;
(2)运用盐酸能和氢氧化钠反应、还能和碳酸钠反应的性质解答;
(3)运用碳酸钠即为了除去钙离子也为了除去氯化钡解答;
(4)运用对淡化膜右侧的海水加压,水分子可以透过淡化膜进入左侧淡水池,而海水中的各种离子不能通过淡化膜,从而得到淡水这一信息和过滤、淡化膜的区别和共同点解答解答.
点评:熟记过滤方法及原理、蒸发的操作的要求、盐酸的性质、碳酸钠的性质,会判断复分解反应发生的条件并熟练书写出相应的生成物.

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
海洋是个巨大的资源宝库,它不仅孕育着无数的生命,还含有大量的化学物质.Ⅰ.海水制溴.从海水中提取的溴约占世界溴产量的1/3,工业上常用“吹出法”制溴,其工艺流程如下: 试回答:
试回答:
(1)步骤②中的化学方程式为2NaBr+Cl2=2NaCl+Br2,其反应类型是 .
(2)非金属单质也具有类似金属与盐溶液之间的反应规律,如在溶液中可发生下列反应:Cl2+2KBr=2KCl+Br2
Br2+2KI=2KBr+I2,由此可判断C12、I2、Br2活动性由强到弱顺序是 .
Ⅱ.食盐制碱.我国著名化学家侯德榜发明的联合制碱法的主要过程是:①向浓氨水中通入足量的二氧化碳生成碳酸氢铵溶液;②然后向溶液中加入食盐细粒充分搅拌,控制条件,利用物质的性质不同,两者发生反应生成碳酸氢钠.便有品体析出;③将析出的碳酸氢钠加热制得碳酸钠、二氧化碳和水.
四种盐在不同温度下的溶解度表:
请回答:
(3)过程①中发生反应的化学方程式 ,该反应类型 .
(4)根据溶解度表分析过程②中能发生反应的原因是 ,过程②发生的化学方程式 该反应的类型为 .
(5)过程③中反应的化学方程式是 .
 试回答:
试回答:(1)步骤②中的化学方程式为2NaBr+Cl2=2NaCl+Br2,其反应类型是
(2)非金属单质也具有类似金属与盐溶液之间的反应规律,如在溶液中可发生下列反应:Cl2+2KBr=2KCl+Br2
Br2+2KI=2KBr+I2,由此可判断C12、I2、Br2活动性由强到弱顺序是
Ⅱ.食盐制碱.我国著名化学家侯德榜发明的联合制碱法的主要过程是:①向浓氨水中通入足量的二氧化碳生成碳酸氢铵溶液;②然后向溶液中加入食盐细粒充分搅拌,控制条件,利用物质的性质不同,两者发生反应生成碳酸氢钠.便有品体析出;③将析出的碳酸氢钠加热制得碳酸钠、二氧化碳和水.
四种盐在不同温度下的溶解度表:
| 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | |
| 氯化钠 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 |
| 碳酸氢铵 | 15.8 | 21.0 | 27.0 | ||
| 碳酸氢钠 | 8.1 | 9.6 | 11.1 | 12.7 | |
| 氯化铵 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 |
(3)过程①中发生反应的化学方程式
(4)根据溶解度表分析过程②中能发生反应的原因是
(5)过程③中反应的化学方程式是
海洋是个巨大的资源宝库,它不仅孕育着无数的生命,还含有大量的化学物质.
I.海水提溴.从海水中提取的溴约占世界溴产量的
,工业上常用“吹出法”制溴,其工艺流程如下:
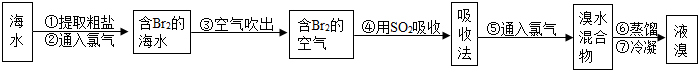
试回答:
(1)步骤②中的化学方程式为2NaBr+Cl2=2NaCl+Br2,其反应类型是 ,
(2)非金属单质也具有类似金属与盐溶液之间的反应规律,如在溶液中可发生下列反应:Cl2+2KBr=2KCl+Br2Br2+2KI=2KBr2+I2
由此可判断Cl2、I2、Br2活动性由强到弱顺序是 .
Ⅱ.食盐制碱.我国著名化学家侯德榜发明的联合制碱法的主要过程是:①向浓氨水中通人足量的二氧化碳生成碳酸氢铵溶液;②然后向溶液中加入食盐细粒充分搅拌,控制条件,利用物质的性质不同,两者发生反应生成碳酸氢钠,便有晶体析出;③将析出的碳酸氢钠加热制得碳酸钠、二氧化碳和水.
四种盐在不同温度下的溶解度表:
请回答:
(1)碳酸氢铵的化学式是 .
(2)由上表分析过程②中能发生反应的原因是 .
(3)过程③中反应的化学方程式是 .
I.海水提溴.从海水中提取的溴约占世界溴产量的
| 1 |
| 3 |

试回答:
(1)步骤②中的化学方程式为2NaBr+Cl2=2NaCl+Br2,其反应类型是
(2)非金属单质也具有类似金属与盐溶液之间的反应规律,如在溶液中可发生下列反应:Cl2+2KBr=2KCl+Br2Br2+2KI=2KBr2+I2
由此可判断Cl2、I2、Br2活动性由强到弱顺序是
Ⅱ.食盐制碱.我国著名化学家侯德榜发明的联合制碱法的主要过程是:①向浓氨水中通人足量的二氧化碳生成碳酸氢铵溶液;②然后向溶液中加入食盐细粒充分搅拌,控制条件,利用物质的性质不同,两者发生反应生成碳酸氢钠,便有晶体析出;③将析出的碳酸氢钠加热制得碳酸钠、二氧化碳和水.
四种盐在不同温度下的溶解度表:
| 温度 溶解度/g 盐 |
10℃ | 20℃ | 30℃ | 40℃ | 50℃ |
| 氯化钠 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 |
| 碳酸氢铵 | 15.8 | 21.0 | 27.0 | ------- | ------- |
| 碳酸氢钠 | 8.1 | 9.6 | 11.1 | 12.7 | ------- |
| 氯化铵 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 |
(1)碳酸氢铵的化学式是
(2)由上表分析过程②中能发生反应的原因是
(3)过程③中反应的化学方程式是
海洋是个巨大的资源宝库,它不仅孕育着无数的生命,还含有大量的化学物质.
I.海水提溴.从海水中提取的溴约占世界溴产量的
,工业上常用“吹出法”制溴,其工艺流程如下:
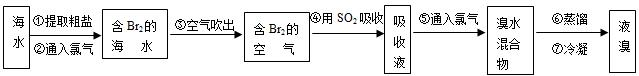
试回答:
(1)步骤②中的化学方程式为2NaBr+Cl2=2NaCl+Br2,其反应类型是 ,
(2)非金属单质也具有类似金属与盐溶液之间的反应规律,如在溶液中可发生下列反应:Cl2+2KBr=2KCl+Br2Br2+2KI=2KBr2+I2
由此可判断Cl2、I2、Br2活动性由强到弱顺序是 .
Ⅱ.食盐制碱.我国著名化学家侯德榜发明的联合制碱法的主要过程是:①向浓氨水中通人足量的二氧化碳生成碳酸氢铵溶液;②然后向溶液中加入食盐细粒充分搅拌,控制条件,利用物质的性质不同,两者发生反应生成碳酸氢钠,便有晶体析出;③将析出的碳酸氢钠加热制得碳酸钠、二氧化碳和水.
四种盐在不同温度下的溶解度表:
请回答:
(1)碳酸氢铵的化学式是 .
(2)由上表分析过程②中能发生反应的原因是 .
(3)过程③中反应的化学方程式是 .
I.海水提溴.从海水中提取的溴约占世界溴产量的
| 1 |
| 3 |

试回答:
(1)步骤②中的化学方程式为2NaBr+Cl2=2NaCl+Br2,其反应类型是
(2)非金属单质也具有类似金属与盐溶液之间的反应规律,如在溶液中可发生下列反应:Cl2+2KBr=2KCl+Br2Br2+2KI=2KBr2+I2
由此可判断Cl2、I2、Br2活动性由强到弱顺序是
Ⅱ.食盐制碱.我国著名化学家侯德榜发明的联合制碱法的主要过程是:①向浓氨水中通人足量的二氧化碳生成碳酸氢铵溶液;②然后向溶液中加入食盐细粒充分搅拌,控制条件,利用物质的性质不同,两者发生反应生成碳酸氢钠,便有晶体析出;③将析出的碳酸氢钠加热制得碳酸钠、二氧化碳和水.
四种盐在不同温度下的溶解度表:
| 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | |
| 氯化钠 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 |
| 碳酸氢铵 | 15.8 | 21.0 | 27.0 | ||
| 碳酸氢钠 | 8.1 | 9.6 | 11.1 | 12.7 | |
| 氯化铵 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 |
(1)碳酸氢铵的化学式是
(2)由上表分析过程②中能发生反应的原因是
(3)过程③中反应的化学方程式是


