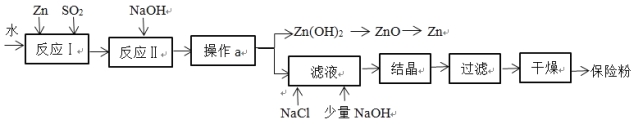
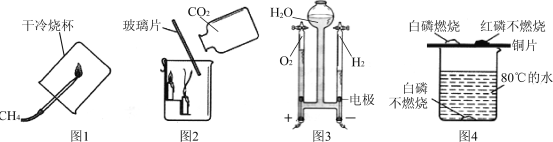
题目内容
【题目】有硫酸铜和硫酸的混合溶液,其中硫元素的质量分数占6.4%。向50g该混合溶液中加入100g氢氧化钠溶液恰好完全反应,下列说法不正确的是( )
A.生成氢氧化铜沉淀的质量一定小于9.8g
B.氢氧化钠溶液中钠元素质量为2.3g
C.反应后所得溶液中溶质的质量为14.2g
D.氢氧化钠溶液中溶质的质量分数为8%
【答案】B
【解析】
向硫酸铜和硫酸的混合溶液中加入氢氧化钠溶液,会发生两个化学反应,化学方程式为:
![]() ,
,![]() 。
。
设钠元素的质量为x,生成的硫酸钠的质量为y,氢氧化钠溶液中溶质的质量分数为z。
根据![]() 和
和![]()
可得关系:

所以氢氧化钠溶液中钠元素质量为4.6g,反应后所得溶液中溶质的质量为14.2g,氢氧化钠溶液中溶质的质量分数为8%。当溶液溶质全部是硫酸铜时,生成9.8g的氢氧化铜沉淀,又因为溶液是硫酸铜和硫酸的混合溶液,所以生成氢氧化铜沉淀的质量一定小于9.8g。故选B。

练习册系列答案
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案
相关题目