题目内容
某活动小组取32g氧化铁,在高温的条件下用一氧化碳还原,产生的气体用过量的氢氧化钠溶液来吸收,在上述实验中,经测定氢氧化钠溶液增重8.8g,反应后的固体中含有铁和四氧化三铁,计算其中单质铁的质量分数.
考点:根据化学反应方程式的计算
专题:有关化学方程式的计算
分析:根据NaOH溶液增加的质量等于二氧化碳的质量,反应前后元素的质量不变,利用二氧化碳求出氧化铁中减少的氧元素的质量,从而得出剩余氧元素的质量,再求出四氧化三铁的质量进而解答.
解答:解:氢氧化钠溶液增重8.8g,反应产生CO2的质量为8.8g,
8.8g二氧化碳中,氧元素的质量为:8.8g×
×100%=6.4g,则32g氧化铁中减少的氧元素的质量为3.2g,
32g氧化铁中,氧元素的质量为:32g×
×100%=9.6g,铁元素的质量为:32g-9.6gg=22.4g,则反应后剩余氧元素的质量为9.6g-3.2g=6.4g,
四氧化三铁的质量为:6.4g÷
×100%=23.2g,其中铁元素的质量为:23.2g-6.4g=16.8g,则单质铁的质量为:22.4g-16.8g=5.6g,反应后的固体的质量为32g-3.2g=28.8g.
最终固体中单质铁的质量分数为:
×100%=19.4%
答案:其中单质铁的质量分数19.4%
8.8g二氧化碳中,氧元素的质量为:8.8g×
| 32 |
| 44 |
32g氧化铁中,氧元素的质量为:32g×
| 16×3 |
| 160 |
四氧化三铁的质量为:6.4g÷
| 16×4 |
| 232 |
最终固体中单质铁的质量分数为:
| 5.6g |
| 32g-3.2g |
答案:其中单质铁的质量分数19.4%
点评:本题综合性较强,较全面的考查了一氧化碳还原氧化铁,尤其是利用数据对混合物的判断增加了试题难度,掌握反应前后元素的质量不变,并会结合方程式分析即可顺利解答.

练习册系列答案
相关题目
化学科学常需要借助化学专用语言来描述,下列化学用语与其含义相符的是( )
| A、3N-3个氮元素 | ||
| B、Mg2+-正二价的镁元素 | ||
C、
| ||
| D、2H2-2个氢分子 |
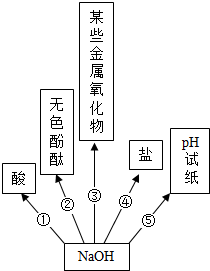 某化学活动小组以“酸碱盐的性质”为主题进行探究性学习,请你作为该小组成员一起来解决下列问题:
某化学活动小组以“酸碱盐的性质”为主题进行探究性学习,请你作为该小组成员一起来解决下列问题:

 金属材料在生活中使用广泛.
金属材料在生活中使用广泛.