题目内容
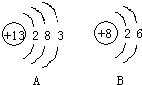
下图是元素周期表中1—18号元素的原子结构示
意图,观察下图,探究下列问题:


(1)核外电子是 排布的。第一层电子数不超过 个;第二层电子数不超过 个;最外层电子数不超过 个。
(2)周期数== 。同一周期的元素,① 相同;
② 逐渐递增;③每周期开头的是 类型的元素,靠近尾部的是 类型的元素,结尾的是 类型的元素。
(3)族数== 。同族元素,① 相同;
② 相似;③ 逐渐递增。
(4)填充下表:
| 元素种类 | 举 例 | 原子的最外层电子数 | 得失电子的趋势 | 元素的化学性质 |
| ①金属元素 | Na、Mg、Al | |||
| ②非金属元素 | O、Cl、S、P | |||
| ③稀有气体元素 | He、Ne、Ar |
(5)最外层为 个电子(只有1个电子层时 个)的结构称为稳定结构。在化学反应中,元素的原子通过得或失电子形成相对稳定结构。
结论:元素的化学性质与 ,特别是 有密切的关系。即 决定元素的化学性质。
(1)分层 2 8 8(2)原子的电子层数 ①原子的电子层数 ②从左到右原子的最外层电子数 ③金属 非金属 稀有气体
(3)原子的最外层电子数 ① 原子的最外层电子数 ② 元素的化学性质
③ 从上到下原子的电子层数
(4)①一般少于4个 失电子 不稳定 ②一般多于或等于4个 得电子 不稳定
③ 8个电子(He为2个) 一般不得失电子 比较稳定
(5)8 2 与其原子的核外电子排布 最外层电子的数目 原子的最外层电子数

 口算题天天练系列答案
口算题天天练系列答案