题目内容
人类对原子结构的认识永无止境.
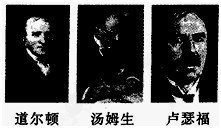
(1)道尔顿认为原子是“不可再分的实心球体”,汤姆生认为原子是“嵌着葡萄干的面包”,如今这些观点均
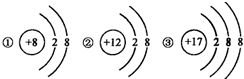
(2)下图①、②是氧元素、钙元素在元素周期表中的信息,A、B、C、D是四种粒子的结构示意图.

①、氧元素的相对原子质量为
②、D中的X=
③、以上A、B、C、D粒子结构示意图中,表示稀有气体元素的原子的是
④、B和
⑤、A、B、C、D粒子中化学性质相似的是
(3)元素周期表是学习化学的重要工具.下面是元素周期表中1~18号元素原子核外电子排布,我们对它进行研究:

①、第16号元素属于
中容易
②、元素的化学性质与原子结构中的
③、在同一族中,各元素的原子结构呈现的规律有
④、研究表明:第二周期从3--9号元素的原子电子层数相同,核电荷数逐渐增大,核对核外电子的引力逐渐增大,故原子半径逐渐减小.我分析第三周期从11--17号元素原子半径变化规律是

(1)道尔顿认为原子是“不可再分的实心球体”,汤姆生认为原子是“嵌着葡萄干的面包”,如今这些观点均
错误
错误
(填“正确”或“错误”),卢瑟福进行α粒子散射实验后,认为原子是“行星模型”,即原子是由带正
正
电荷的原子核和核外电子构成.(2)下图①、②是氧元素、钙元素在元素周期表中的信息,A、B、C、D是四种粒子的结构示意图.

①、氧元素的相对原子质量为
16.00
16.00
,钙元素的原子序数(即质子数)为20
20
;②、D中的X=
11
11
;③、以上A、B、C、D粒子结构示意图中,表示稀有气体元素的原子的是
A
A
;④、B和
C
C
属于同种元素的粒子(用“A”、“C”、“D”填空).⑤、A、B、C、D粒子中化学性质相似的是
A
A
和C
C
(填序号);(3)元素周期表是学习化学的重要工具.下面是元素周期表中1~18号元素原子核外电子排布,我们对它进行研究:

①、第16号元素属于
非金属
非金属
元素(填“金属”或“非金属”),它在化学反应中容易
得
得
(填“得”或“失”)电子;②、元素的化学性质与原子结构中的
最外层电子
最外层电子
数关系密切;③、在同一族中,各元素的原子结构呈现的规律有
从左到右各原子的质子数依次递增
从左到右各原子的质子数依次递增
(任写一点);④、研究表明:第二周期从3--9号元素的原子电子层数相同,核电荷数逐渐增大,核对核外电子的引力逐渐增大,故原子半径逐渐减小.我分析第三周期从11--17号元素原子半径变化规律是
原子半径逐渐减小
原子半径逐渐减小
.分析:(1)原子结构的认识历史,现代原子理论认为原子是由居于原子中心带正电的原子核和核外电子构成;
(2)①由题目中氧元素、钙元素在元素周期表中的信息,可知:氧元素的相对原子质量、钙元素的原子序数(即质子数);
②根据“核内质子数=核外电子数”,结合D粒子的结构示意图,可知D中的X的值;
③稀有气体元素的原子有8个电子的稳定结构;
④掌握元素的概念:具有相同核电荷数(即质子数)的一类原子总称,BC质子数相同;
⑤据元素的化学性质跟它的原子的最外层电子数目有关,最外层电子数相同的元素化学性质相似,进行解答.
(3)①根据元素周期表可知,第16号元素名称、由其汉语名称可知其元素种类、由最外层电子数可知得失电子情况;
②元素的化合价数值一般与它的原子最外层电子数有关;或元素的化合价与该元素的离子所带的电荷数有关进行分析即可.
③根据元素周期律,同一周期中,随质子数或原子序数的递增(或从左到右)各原子的(最外层)电子数依次增多,进行解答.
④总结规律:“第二周期从3号~9号元素的原子电子层数相同,核电荷数逐渐增大,核对核外电子的引力逐渐增大,故原子半径逐渐减小”,利用知识迁移,则可知第三周期从11号~17号元素原子半径变化规律.
(2)①由题目中氧元素、钙元素在元素周期表中的信息,可知:氧元素的相对原子质量、钙元素的原子序数(即质子数);
②根据“核内质子数=核外电子数”,结合D粒子的结构示意图,可知D中的X的值;
③稀有气体元素的原子有8个电子的稳定结构;
④掌握元素的概念:具有相同核电荷数(即质子数)的一类原子总称,BC质子数相同;
⑤据元素的化学性质跟它的原子的最外层电子数目有关,最外层电子数相同的元素化学性质相似,进行解答.
(3)①根据元素周期表可知,第16号元素名称、由其汉语名称可知其元素种类、由最外层电子数可知得失电子情况;
②元素的化合价数值一般与它的原子最外层电子数有关;或元素的化合价与该元素的离子所带的电荷数有关进行分析即可.
③根据元素周期律,同一周期中,随质子数或原子序数的递增(或从左到右)各原子的(最外层)电子数依次增多,进行解答.
④总结规律:“第二周期从3号~9号元素的原子电子层数相同,核电荷数逐渐增大,核对核外电子的引力逐渐增大,故原子半径逐渐减小”,利用知识迁移,则可知第三周期从11号~17号元素原子半径变化规律.
解答:解:(1)道尔顿、汤姆生等人的观点均错误;原子是由居于原子中心的带正电的原子核和核外电子构成.
(2)①由题目中氧元素、钙元素在元素周期表中的信息,可知:氧元素的相对原子质量16.00、钙元素的原子序数(即质子数)为20;
②根据“核内质子数=核外电子数”,结合D粒子的结构示意图,则X=2+8+1=11;
③稀有气体元素的原子有8个电子的稳定结构,故选A
④因为“具有相同核电荷数(即质子数)的一类原子总称为元素”,故B和C属于同种元素的粒子,因为它们质子数相同;
⑤根据元素的化学性质跟它的原子的最外层电子数目有关,最外层电子数相同的元素化学性质相似,A粒子的化学性质与C粒子化学性质相似.
(3)①根据元素周期表可知,第16号元素名称是镁元素,它属于非金属元素,它在化学反应中容易得电子;
②原子在相互化合是存在得失电子或形成共用电子对,都与最外层电子数有关,所以元素的化学性质与原子的最外层电子数关系密切.
③根据元素周期律,同一周期中,随质子数或原子序数的递增(或从左到右)各原子的(最外层)电子数依次增多.
④研究表明:第二周期从3号~9号元素的原子电子层数相同,核电荷数逐渐增大,核对核外电子的引力逐渐增大,故原子半径逐渐减小.利用知识迁移,则可分析第三周期从11号~17号元素原子半径变化规律是原子半径逐渐减小.
故答案为:(1)错误;正(2)①16.00;20;②11;③A;④C;⑤A;C(3)①非金属;得;②最外层电子;③从左到右各原子的质子数依次递增;④原子半径逐渐减小
(2)①由题目中氧元素、钙元素在元素周期表中的信息,可知:氧元素的相对原子质量16.00、钙元素的原子序数(即质子数)为20;
②根据“核内质子数=核外电子数”,结合D粒子的结构示意图,则X=2+8+1=11;
③稀有气体元素的原子有8个电子的稳定结构,故选A
④因为“具有相同核电荷数(即质子数)的一类原子总称为元素”,故B和C属于同种元素的粒子,因为它们质子数相同;
⑤根据元素的化学性质跟它的原子的最外层电子数目有关,最外层电子数相同的元素化学性质相似,A粒子的化学性质与C粒子化学性质相似.
(3)①根据元素周期表可知,第16号元素名称是镁元素,它属于非金属元素,它在化学反应中容易得电子;
②原子在相互化合是存在得失电子或形成共用电子对,都与最外层电子数有关,所以元素的化学性质与原子的最外层电子数关系密切.
③根据元素周期律,同一周期中,随质子数或原子序数的递增(或从左到右)各原子的(最外层)电子数依次增多.
④研究表明:第二周期从3号~9号元素的原子电子层数相同,核电荷数逐渐增大,核对核外电子的引力逐渐增大,故原子半径逐渐减小.利用知识迁移,则可分析第三周期从11号~17号元素原子半径变化规律是原子半径逐渐减小.
故答案为:(1)错误;正(2)①16.00;20;②11;③A;④C;⑤A;C(3)①非金属;得;②最外层电子;③从左到右各原子的质子数依次递增;④原子半径逐渐减小
点评:了解元素周期表的特点及其应用;掌握元素的概念:具有相同核电荷数(即质子数)的一类原子总称;了解原子结构示意图与离子结构示意图的特点.

练习册系列答案
 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案
相关题目

 20、
20、 人类对原子结构的认识永无止境.
人类对原子结构的认识永无止境. 8、人类对原子结构的认识是逐渐深入的.如图是不同时期科学家提出的原子结构模型.
8、人类对原子结构的认识是逐渐深入的.如图是不同时期科学家提出的原子结构模型. 人类对原子结构的认识永无止境.
人类对原子结构的认识永无止境.