题目内容
(1)在“南海一号”打捞出来的文物中,“金龙纹手镯”光彩夺目,完好无损;铜镜表面有铜锈;铁器则锈迹斑斑,残存很少,这说明金、铜、铁这三种金属的活动顺序由强到弱的顺序是 ;(2)生铁和钢是世界上用量最大的 (填“金属材料”或“合成材料”);炼铁的原理是利用一氧化碳与氧化铁反应,反应的化学方程式为 .写出防止铁生锈的一种方法是 .
(3)将少量的铁粉加入到足量的硫酸铜溶液中,反应的化学方程式为 .
【答案】分析:(1)根据金属是否容易生锈考虑本题;
(2)根据金属材料的分类、炼铁的原理写出反应的方程式,根据铁生锈的条件分析防止铁生锈的措施;
(3)根据铁与硫酸铜的反应写出反应的方程式.
解答:解:(1)金属活动性越强,越容易生锈,由“金龙纹手镯”光彩夺目,完好无损;铜镜表面有铜锈;铁器则锈迹斑斑,残存很少,可知铁最活泼,铜次之,金最不活泼.所以,三种金属的活动顺序由强到弱的顺序是 铁>铜>金;
(2)金属材料包括金属盒合金,生铁和钢都是铁的合金,属于金属材料;炼铁的原理是在温条件下一氧化碳与氧化铁,生成了铁和二氧化碳,反应的方程式是:Fe2O3+3CO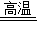 2Fe+3CO2;铁生锈的条件是铁与氧气、水接触,所以,防止铁生锈的方法是在铁制品的表面涂油或刷漆,保持铁制品表面的干燥和洁净等;
2Fe+3CO2;铁生锈的条件是铁与氧气、水接触,所以,防止铁生锈的方法是在铁制品的表面涂油或刷漆,保持铁制品表面的干燥和洁净等;
(3)将少量的铁粉加入到足量的硫酸铜溶液中,铁与硫酸铜反应生成了铜和硫酸亚铁,反应的方程式是:Fe+CuSO4═Cu+FeSO4.
故答为:(1)铁>铜>金;(2)金属材料,Fe2O3+3CO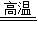 2Fe+3CO2,在铁制品的表面涂油或刷漆,(3)Fe+CuSO4═Cu+FeSO4.
2Fe+3CO2,在铁制品的表面涂油或刷漆,(3)Fe+CuSO4═Cu+FeSO4.
点评:解答本题关键是熟记金属活动性及其应用,熟练掌握方程式的书写方法.
(2)根据金属材料的分类、炼铁的原理写出反应的方程式,根据铁生锈的条件分析防止铁生锈的措施;
(3)根据铁与硫酸铜的反应写出反应的方程式.
解答:解:(1)金属活动性越强,越容易生锈,由“金龙纹手镯”光彩夺目,完好无损;铜镜表面有铜锈;铁器则锈迹斑斑,残存很少,可知铁最活泼,铜次之,金最不活泼.所以,三种金属的活动顺序由强到弱的顺序是 铁>铜>金;
(2)金属材料包括金属盒合金,生铁和钢都是铁的合金,属于金属材料;炼铁的原理是在温条件下一氧化碳与氧化铁,生成了铁和二氧化碳,反应的方程式是:Fe2O3+3CO
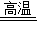 2Fe+3CO2;铁生锈的条件是铁与氧气、水接触,所以,防止铁生锈的方法是在铁制品的表面涂油或刷漆,保持铁制品表面的干燥和洁净等;
2Fe+3CO2;铁生锈的条件是铁与氧气、水接触,所以,防止铁生锈的方法是在铁制品的表面涂油或刷漆,保持铁制品表面的干燥和洁净等;(3)将少量的铁粉加入到足量的硫酸铜溶液中,铁与硫酸铜反应生成了铜和硫酸亚铁,反应的方程式是:Fe+CuSO4═Cu+FeSO4.
故答为:(1)铁>铜>金;(2)金属材料,Fe2O3+3CO
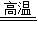 2Fe+3CO2,在铁制品的表面涂油或刷漆,(3)Fe+CuSO4═Cu+FeSO4.
2Fe+3CO2,在铁制品的表面涂油或刷漆,(3)Fe+CuSO4═Cu+FeSO4.点评:解答本题关键是熟记金属活动性及其应用,熟练掌握方程式的书写方法.

练习册系列答案
相关题目