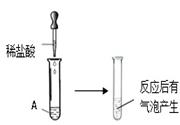
题目内容
某化学小组查阅资料得知:在不同温度下,甲烷(CH4)可将氧化铁(Fe2O3)还原为Fe、Fe3O4中的一种可两种。他们为探究甲烷与氧化铁反应后产物(黑色粉末)的成分,进行了如下实验:
(1)按右图装置连接好仪器,检查装置的气密性后,往装置中添加药品。
①各黑色粉末中滴加稀硫酸,观察到有气泡产生,则黑色粉末中含有 ,产生气泡的化学方程式是 。
②导管b的作用是 。
(2)按下图装置连接好仪器(图中夹持设备已略去)检查装置的气密性,往装置中添加药品,打开止水夹K通入含有少量二氧化碳的的一氧化碳,持续一段时间后再点燃装置C处的酒精喷灯。
①装置A中反应的化学方程式为 ,装置B中浓硫酸的作用是 。
②持续一段时间后再点燃装置C处的酒精喷灯的原因是 。D装置的作用是 。
③实验中观察到装置E中石灰水变浑浊,则黑色粉末中含有 。尾气处理方法为 。
(1)①Fe+H2SO4=FeSO4+H2↑ 。
② 防止滴加稀硫酸时生成的气体从分液漏斗逸出 。
(2)①2NaOH+CO2=Na2CO3+H2O 除去气体中的水蒸气 。
② 防止CO与空气的混合气加热时发生爆炸 防止E中的石灰水被倒吸进玻璃管 。
③Fe3O4 将尾气点燃 。
解析试题分析:(1)①向黑色粉末中滴加稀硫酸,观察到有气泡产生,说明在黑色粉末中含有铁。铁与稀硫酸反应生成氢气。化学方程式为Fe+H2SO4=FeSO4+H2↑。
②当打开分液漏斗的开关时,如瓶内压强过大,气体可从漏斗中溢出。所以导管b的作用是防止滴加稀硫酸时生成的气体从分液漏斗逸出。
(2)①装置A中的氢氧化钠可与混合物中的二氧化碳反应,反应的化学方程式为:2NaOH+CO2=Na2CO3+H2O 。浓硫酸有吸水性可除去气体中的水蒸气 。
②持续通入气体一段时间后再点燃装置C处的酒精喷灯的原因是将装置内的空气排尽,防止CO与空气的混合气加热时发生爆炸。D装置的作用是当停止加热时,装置内的温度降低,气压减小,防止E中的石灰水被倒吸进玻璃管。
③实验中观察到装置E中石灰水变浑浊,即说明黑色粉末与一氧化碳反应生成了二氧化碳。所以黑色粉末中含有铁的氧化物,即Fe3O4。尾气处理的方法可将尾气点燃(或用气囊收集)。
考点:科学探究、一氧化碳和二氧化碳的性质、固体成分的确定

(6分)【实验探究】
(1)请你依据下图设计一个酸和碱反应的探究实验: 
| 实验步骤 | 实验现象 | 结论 |
| ①向烧杯中加入10mL氢氧化钠溶液,并滴入几滴酚酞试液 ②再用滴管慢慢滴入稀硫酸,并不断搅拌溶液。 | ①溶液颜色 ; ②不断搅拌溶液至溶液颜色变成 色。 | 酸和碱发生了中和反应 |
(2)为探究上述酸、碱反应后硫酸是否过量,甲、乙、丙三位同学设计了以下方案:
| 实验方案 | 实验步骤 | 实验现象 | 实验结论 |
| 甲同学的方案 | 取样,滴入适量的氯化钡溶液 | 出现白色沉淀 | 硫酸过量 |
| 乙同学的方案 | 取样,滴入几滴无色酚酞溶液 | 酚酞溶液不变色 | 酸、碱恰好完全反应 |
| 丙同学的方案 | 取样,滴入几滴紫色石蕊溶液 | 溶液变红 | 硫酸过量 |
①三个方案中只有 是正确的(填“甲”、“乙”、“丙”)。
②请分析另外两个同学方案错误的原因:
一个错误的原因是 ,
另一个错误的原因是 。
【实验反思】探究硫酸和氢氧化钠反应后硫酸是否有剩余,还可选择一种试剂
(8分)厨房中有一包无标识的白色粉末,经初步认定可能是氯化钠、碳酸钠、碳酸氢钠中的一种。小明对白色粉末的成分进行了探究。
[查阅资料]碳酸钠俗称 、苏打,碳酸氢钠俗称小苏打,两者都属于 (选填“酸”、“碱”、“盐”),都能溶于水,且水溶液都呈碱性。
[实验探究]小明取适量白色粉末,配制成溶液,按表中所示实验方案进行探究。
| 实验步骤 | 实验内容 | 实验现象 | 实验结论 |
| 1 | 取少量溶液,滴加无色酚酞溶液 | 溶液变红色 | 白色粉末肯定不是 |
| 2 | 取少量溶液,滴加稀盐酸 | | |
| 3 | 取少量溶液,滴加澄清石灰水 | 产生白色沉淀 | |
(2)实验步骤2中可能发生反应的化学方程式为 (写出一个即可)。实验步骤3中白色沉淀的成分是 (填写化学式)。
[实验反思]小明实验后发现上述实验方案并不能确定白色粉末的组成。经老师指导后,小明再取少量配制的溶液滴加氯化钙溶液,没有观察到明显现象,则该白色粉末是 。
(8分)常温下没有氧气存在时,铁与水几乎不反应,但高温下,铁与水蒸气能反应生成一种常见铁的氧化物和一种气体。小明很好奇,设计如下实验探究铁粉与水蒸气反应后的产物。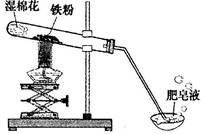
(1)试管尾部放一团湿棉花的目的是_______________。
(2)探究生成的气体是什么?
用燃着的木条靠近肥皂泡,有爆鸣声,稍后有肥皂泡飘到空中。 说明生成的气体是______________。
(3)探究试管中剩余固体成分是什么?
【查阅资料】
| 常见铁的氧化物 | FeO | Fe2O3 | Fe3O4 |
| 颜色、状态 | 黑色粉末 | 红棕色粉末 | 黑色晶体 |
| 能否被磁铁吸引 | 否 | 否 | 能 |
【猜想与假设】猜想一:剩余固体是Fe与Fe3O4;猜想二:剩余固体是_____________。
【实验探究】
| 实验操作 | 实验现象及结论 |
| | |
【反思与交流】该黑色固体不可能是Fe2O3,理由是_______________________________。
(7分)同学们在学习Ca(OH)2的化学性质时,对Ca(OH)2溶液和Na2CO3溶液反应后溶液中溶质的成分进行探究。请你一同探究并回答下列问题:
【提出问题】:滤液中的溶质是什么物质?溶液呈中性。
【查阅资料】:①Ca(NO3)2溶液呈中性。 ②Ca(NO3)2 +Na2CO3= CaCO3↓+2NaNO3
【猜想假设】:甲同学认为:只含有NaOH; 乙同学认为:只含有NaOH Ca(OH)2;
丙同学认为:含有NaOH Ca(OH)2 Na2CO3; 你认为可能含有 。
【分析讨论】:丁同学认为 同学的猜想肯定是不合理的,理由是 。
【实验设计】:请你设计一个简单的实验来验证你的猜想是正确的。
| 实验步骤 | 实验现象 | 实验结论 |
| 取滤液于试管中 | | 猜想正确 |
| 实验步骤 | 实验现象 | 实验结论 |
| 取滤液于试管中滴加少量的稀盐酸 | 无明显现象 | 猜想正确 |
【反思拓展】:在分析化学反应后所得物质的成分时,除了考虑生成物外,还需要考虑
。
(7分)我省赣州稀土资源丰富,稀土开采工序中使用的草酸、硫酸铵等产生的大量废水严重污染农业用水和生活用水。某研究性学习小组对此展开了研究。
[查阅资料]
(一)草酸的化学式为H2C2O4,草酸是一种无色透明的晶体,对人体有害,具有酸的通性:如能与碳酸盐反应产生二氧化碳,能与金属反应等。
例如:H2C2O4+Na2CO3==Na2C2O4+CO2↑+H2O
(二)CO遇到浸有磷钼酸溶液的氯化钯黄色试纸立即变蓝,而CO2遇试纸不变色。
回答下列问题:
(1)写出金属铁与草酸反应的化学方程式
(2)硫酸铵在农业上可作化肥使用,在施肥时不能将它与 混合使用。
[设计方案]草酸加热能分解生成水和气体,研究性学习小组的同学对受热分解生成的气体作如图所示的探究:
[实验探究]该研究性学习小组同学通过观察实验中的现象,验证猜想。
[现象与结论]请你帮助他们完成报告:
| 步骤 | 现象 | 结论 |
| 点燃酒精灯加热,观察装置C和D中的现象 | 装置C中 装置D中 | 产生的气体有CO 产生的气体有CO2 |
(2)根据结论,从环保的角度考虑,装置中存在不足之处,正确的处理方法是
科学探究是奇妙的过程,请你一起参与并填写下列空白。
【提出问题】小森同学在滴加FeCl3溶液时,不小心把滴加FeCl3溶液的滴管放入到盛“双
氧水”(过氧化氢)的试剂瓶中,发现有大量的气泡产生。小森联想到用二氧化锰可作为过氧化氢的催化剂,他想FeCl3溶液能否也可以作为过氧化氢分解的催化剂呢?于是他做了以下探究。
【猜想与假设】FeCl3溶液能作过氧化氢分解的催化剂
【设计与实验】
| 实验步骤 | 实验现象 | 实验结论 |
| 在一支试管中加入5mL15%的H2O2溶液,然后滴入适量的FeCl3溶液,把带火星的木条伸入试管 | | FeCl3溶液可以催化分解H2O2 |
已知FeCl3溶液中含有H2O 、Fe3+和Cl-三种微粒,小森同学又做了三种猜想:
猜想1:真正催化分解H2O2的是FeCl3溶液中的H2O
猜想2:真正催化分解H2O2的是FeCl3溶液中的Fe3+
猜想3:真正催化分解H2O2的是FeCl3溶液中的CI—
你认为最不可能的是哪一种猜想, 。小森同学认为,要验证猜想,至少还需要做 个对比实验。