题目内容
(2010.浙江绍兴35).下图是用铜粉氧化法生产氧化铜的流程图。据图回答下列问题:
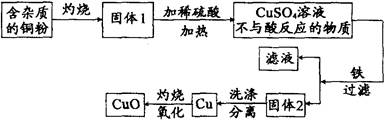
(1)铜粉灼烧后可能有氧化铜和氧化亚铜两种物质。氧化亚铜(Cu2O)中铜元素的化合价是________价。
(2)已知氧化亚铜和稀硫酸反应可生成硫酸铜和铜。假如固体1中只含有铜的氧化物,下列推理合理的是___________(填序号)。
①固体1中加入稀硫酸,若溶液呈蓝色,说明该固体中一定有氧化铜
②固体1中加入稀硫酸,若有红色沉淀物,说明该固体中一定有氧化亚铜
(3)将得到的1.6吨氧化铜全部转化为硫酸铜,可得硫酸铜多少吨?(CuO+H2SO4=CuS04+H2O)
(4)若用贴有如图标签的浓硫酸100毫升可配制溶质质量分数为49%的硫酸溶液_____克。


(1)铜粉灼烧后可能有氧化铜和氧化亚铜两种物质。氧化亚铜(Cu2O)中铜元素的化合价是________价。
(2)已知氧化亚铜和稀硫酸反应可生成硫酸铜和铜。假如固体1中只含有铜的氧化物,下列推理合理的是___________(填序号)。
①固体1中加入稀硫酸,若溶液呈蓝色,说明该固体中一定有氧化铜
②固体1中加入稀硫酸,若有红色沉淀物,说明该固体中一定有氧化亚铜
(3)将得到的1.6吨氧化铜全部转化为硫酸铜,可得硫酸铜多少吨?(CuO+H2SO4=CuS04+H2O)
(4)若用贴有如图标签的浓硫酸100毫升可配制溶质质量分数为49%的硫酸溶液_____克。

(1)+1 (2)②
(3)设可生成硫酸铜质量为X,则
CuO+H2SO4=CuSO4+H2O
80 160
1.6吨 X
80∶160=1.6吨∶X
X=3.2吨
答:可生成硫酸铜3.2吨。
(4)368
(3)设可生成硫酸铜质量为X,则
CuO+H2SO4=CuSO4+H2O
80 160
1.6吨 X
80∶160=1.6吨∶X
X=3.2吨
答:可生成硫酸铜3.2吨。
(4)368
本题考查的是物质的相互转化和制备,金属与酸的化学性质,有关元素化合价的计算,根据化学反应方程式的计算,溶液的稀释。
(1)根据在化合物中正负化合价代数和为零,可设氧化亚铜(Cu2O)中铜元素的化合价为x,2x+(-2)=0,x=+1;
(2)根据氧化铜和氧化亚铜分别与稀硫酸反应的产物判断,①因为Cu2O和CuO与稀硫酸反应都生成蓝色的硫酸铜,所以固体中可能有氧化铜也可能含有Cu2O,故①错误;
②因为氧化亚铜和稀硫酸反应可生成硫酸铜和铜,所以只要有铜存在,就说明一定含有氧化亚铜,故②正确,故选②;
(3)根据题中已知量设出未知量,然后根据化学方程式CuO+H2SO4=CuS04+H2O列比例式求解。
设可得硫酸铜的质量为x,
CuO+H2SO4=CuS04+H2O
80 160
1.6t x
80:160 =1.6t:x
解得x=3.2t
答:可得硫酸铜3.2吨。
(4)根据加水稀释前后溶液的溶质质量不变,计算可配制溶质质量分数为49%的硫酸溶液质量为100ml×1.84g/cm3×98℅÷49℅=368g
(1)根据在化合物中正负化合价代数和为零,可设氧化亚铜(Cu2O)中铜元素的化合价为x,2x+(-2)=0,x=+1;
(2)根据氧化铜和氧化亚铜分别与稀硫酸反应的产物判断,①因为Cu2O和CuO与稀硫酸反应都生成蓝色的硫酸铜,所以固体中可能有氧化铜也可能含有Cu2O,故①错误;
②因为氧化亚铜和稀硫酸反应可生成硫酸铜和铜,所以只要有铜存在,就说明一定含有氧化亚铜,故②正确,故选②;
(3)根据题中已知量设出未知量,然后根据化学方程式CuO+H2SO4=CuS04+H2O列比例式求解。
设可得硫酸铜的质量为x,
CuO+H2SO4=CuS04+H2O
80 160
1.6t x
80:160 =1.6t:x
解得x=3.2t
答:可得硫酸铜3.2吨。
(4)根据加水稀释前后溶液的溶质质量不变,计算可配制溶质质量分数为49%的硫酸溶液质量为100ml×1.84g/cm3×98℅÷49℅=368g

练习册系列答案
相关题目

 下表(假设纸张其他成分既不溶于水,也不与水反应):
下表(假设纸张其他成分既不溶于水,也不与水反应): 3.52
3.52