题目内容
(10眉山24)、(6分)实验室常用锌块和稀盐酸反应制取氢气,若用2.6克锌和稀盐酸反应。则:
(1)可制取多少克氢气?
(2)理论上需要质量分数为14.6﹪的稀盐酸溶液多少克?
(1)可制取多少克氢气?
(2)理论上需要质量分数为14.6﹪的稀盐酸溶液多少克?
(1)0.08g (2)20g
本题考查的是根据化学反应方程式的计算。首先根据反应物,生成物,反应条件正确写出方程式,由方程式求出Zn,HCl 与 H2的质量关系,再由Zn 的质量求出生成氢气的质量和参加反应的HCl的质量,结合盐酸的质量分数求出所需盐酸的质量。
设可制取氢气的质量为x,参加反应的HCl的质量为y
Zn+2HCl=ZnCl2 +H2↑
65 73 2
2.6g y x
65/2 =2.6g/x 65/73 ="2.6g/y"
x=0.08g y=2.92g
2.92g÷14.6%=20g
答:(1)可制取0.08g氢气,(2)理论上需要质量分数为14.6%的稀盐酸溶液20克。
设可制取氢气的质量为x,参加反应的HCl的质量为y
Zn+2HCl=ZnCl2 +H2↑
65 73 2
2.6g y x
65/2 =2.6g/x 65/73 ="2.6g/y"
x=0.08g y=2.92g
2.92g÷14.6%=20g
答:(1)可制取0.08g氢气,(2)理论上需要质量分数为14.6%的稀盐酸溶液20克。

练习册系列答案
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案
相关题目
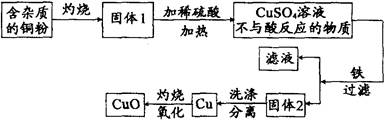


 C6H12O6 + 6O2。若消耗44 t二氧化碳,生成氧气的质量为多少?
C6H12O6 + 6O2。若消耗44 t二氧化碳,生成氧气的质量为多少?