题目内容
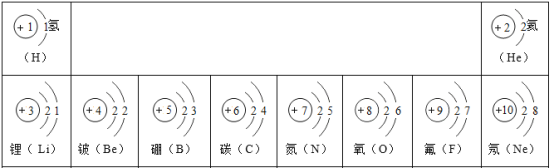
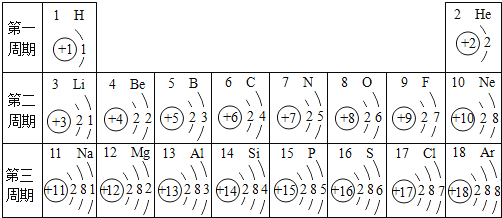
【题目】核电荷数为1-18号元素的原子结构示意图等信息如图,回答下列问题:
(1)硅原子的核电荷数为______;
(2)16号元素的原子在化学反应中比较容易______( “得”或“失”)电子,该元素属于_____(“金属”或“非金属”)元素;
(3)写出表中关于8号元素的一条信息______;
(4)第三周期中,各原子结构的共同之处是______,该周期中,各原子核外电子排布的变化规律是______;
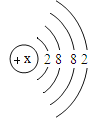
(5)写出核外电子排布与氖原子相同的阳离子和阴离子符号各一个:阳离子____,阴离子_____;
(6)11号元素与17号元素化合物的化学式为_______。
【答案】14 得 非金属 8号元素是氧元素 原子核外电子层数相同 最外层电子数依次增加 Na+ F- NaCl
【解析】
分析元素周期表的排布规律,结合原子结构示意图知识进行解答。
(1)原子的质子数等于核电荷数,依据周期表可知,硅原子的质子数为14,所以硅原子的核电荷数也为14。
(2)16号元素的原子最外层电子数为6,大于4,在化学反应中比较容易得电子。该元素是硫元素,属于非金属元素。
(3)从表中8号元素的方格中可知,该元素是氧元素,元素符号为O等。
(4)在元素周期表中,同一周期,原子核外电子层数相同;该周期中,各原子核外电子排布的变化规律是从左到右,最外层电子数依次增加。
(5)氖原子核外电子数为10,最外层电子数为8,与之结构相同的阳离子,则该原子的核外电子数大于10,且易失电子,例如钠原子,当钠原子失去一个电子,变为Na+,核外电子排布与氖原子相同;与之结构相同的阴离子,该原子的核外电子数小于10,且易得到电子,例如氟原子,当氟原子得到一个电子,变为F-,核外电子排布与氖原子相同。
(6)11号元素是钠元素,最外层电子数为1,反应中易失去一个电子,化合价常显+1价,17号元素是氯元素,最外层电子数为7,反应中易得到一个电子,化合价常显-1价,所以由11号元素与17号元素化合物的化学式为NaCl。