题目内容
(2011?中山二模)某校兴趣小组在实验室中完成制取氧气的实验.他们取氯酸钾和二氧化锰的混合物共3.0g放入大试管中加热,并在不同时刻测定试管内剩余固体物质的质量(如下表):| 反应时间/min | 1.0 | 1.5 | 2.0 | 2.5 | 3.0 | 3.5 |
| 剩余固体质量/g | 2.55 | 2.25 | 2.10 | 2.04 | M | 2.04 |
(1)完全反应后,生成氧气的质量为______g;
(2)根据表中数据分析M的值是______g
(3)原混合物中氯酸钾的质量分数是多少?(请写出计算过程)
【答案】分析:(1)欲知完全反应后,生成氧气的质量,须知根据质量守恒定律,反应前后物质的质量总和相等,由此可计算出生成氧气的质量;
(2)依据加热到到2.5min-3.5min是固体的剩余固体的质量解决.
(3)欲求原混合物中氯酸钾的质量分数,需先根据化学方程式,求出氯酸钾的质量,进而求出混合物中氯酸钾的质量分数.
解答:解:(1)根据质量守恒定律,反应前后物质的质量总和相等,则生成氧气的质量=反应前物质的质量-反应后剩余固体的质量=3.0g-2.04g=0.96g
故答案为:0.96g;
(2)当加热到2.5min时剩余固体的质量是2.04g,达到3.5min时仍为2.04g,说明加热到3.0min时固体也是2.04g
故答案为2.04
(3)解:设原混合物中氯酸钾的质量为x
2KClO3 2KCl+3O2↑
2KCl+3O2↑
245 96
x 0.96g
∴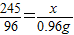
解得:x=2.45g
氯酸钾的质量分数= ×100%≈81.7%
×100%≈81.7%
答:原混合物中氯酸钾的质量分数为81.7%.
点评:本题主要考查学生对物质质量守恒定律的认识以及利用化学方程式和质量分数公式进行计算的能力,解题的关键是利用质量守恒定律求出氧气的质量.
(2)依据加热到到2.5min-3.5min是固体的剩余固体的质量解决.
(3)欲求原混合物中氯酸钾的质量分数,需先根据化学方程式,求出氯酸钾的质量,进而求出混合物中氯酸钾的质量分数.
解答:解:(1)根据质量守恒定律,反应前后物质的质量总和相等,则生成氧气的质量=反应前物质的质量-反应后剩余固体的质量=3.0g-2.04g=0.96g
故答案为:0.96g;
(2)当加热到2.5min时剩余固体的质量是2.04g,达到3.5min时仍为2.04g,说明加热到3.0min时固体也是2.04g
故答案为2.04
(3)解:设原混合物中氯酸钾的质量为x
2KClO3
 2KCl+3O2↑
2KCl+3O2↑245 96
x 0.96g
∴
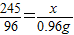
解得:x=2.45g
氯酸钾的质量分数=
 ×100%≈81.7%
×100%≈81.7%答:原混合物中氯酸钾的质量分数为81.7%.
点评:本题主要考查学生对物质质量守恒定律的认识以及利用化学方程式和质量分数公式进行计算的能力,解题的关键是利用质量守恒定律求出氧气的质量.

练习册系列答案
 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案
相关题目
 ”.资料上这个化学方程式中最后一种物质的化学式印刷不清楚,请推测其化学式:.
”.资料上这个化学方程式中最后一种物质的化学式印刷不清楚,请推测其化学式:.