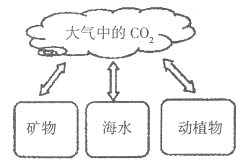
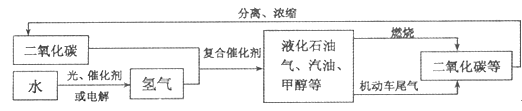
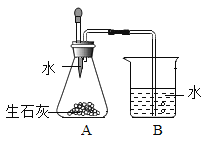
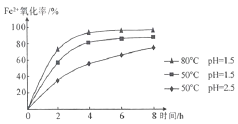
题目内容
【题目】关于配制50g 8%的氢氧化钠溶液,下列说法正确的是( )
A. 用量筒量取![]() 水
水
B. 将氢氧化钠固体放在小烧杯中称量
C. 把称量好的氢氧化钠固体放入量筒中溶解
D. 配制好的溶液存放在带玻璃塞的广口瓶中
【答案】B
【解析】
A、溶质质量=溶液质量×溶质的质量分数,配制50g 8%的氢氧化钠溶液,需氯化钠的质量=50g×8%=4g;溶剂质量=溶液质量-溶质质量,则所需水的质量=50g-4g=46g(合46mL),故选项说法错误。
B、氢氧化钠具有腐蚀性,应将氢氧化钠固体放在小烧杯中称量,故选项说法正确。
C、把称量好的氢氧化钠固体放入烧杯中溶解,不能在量筒内溶解,故选项说法错误。
D、氢氧化钠能与玻璃的主要成分发生化学反应,配制好的溶液存放在细口瓶中,且不能用玻璃塞,故选项说法错误。
故选:B。

 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
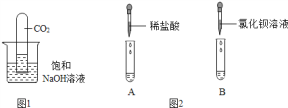
阳光同学一线名师全优好卷系列答案【题目】甲同学为了区别氢氧化钠和氢氧化钙溶液,设计了如图所示的四组实验方案.

(1)其中能达到实验目的是 .
(2)在C组实验中发生的化学方程式为 .
(3)实验结束后,甲同学将A、C组四支试管中的溶液倒入同一容器中,看到溶液变浑浊,该现象说明有 物质生成(填化学式),滴入酚酞后溶液呈红色.
(4)滴入酚酞后溶液呈红色,说明溶液呈碱性.使溶液呈碱性的物质是什么呢?甲同学进一步推测:溶液中呈碱性的物质可能是碳酸钠、氢氧化钙和 三种物质中的一种,或是三种物质两两混合组成的混合物.
(5)为了验证推测,甲同学查阅资料,获悉氯化钡溶液呈中性,并设计如下实验加以验证.请根据要求完成下列空白:
实验内容 | 预测现象 | 结论 |
取少量容器中的上层溶液于试管中,加入过量的氯化钡溶液,静置 | ①若有白色沉淀,溶液呈无色 | 物质是碳酸钠 |
②若无沉淀生成,溶液呈红色 | 物质是氢氧化钙 | |
③若有白色沉淀,溶液呈红色 |
(6)乙同学认为甲同学第②步验证的结论不严密,原因是 .