题目内容
(3分)在一烧杯中盛有42.2g碳酸钙和氯化钙的粉末状混合物,向其中加入116.6g水,使氯化钙完全溶解。然后向其中逐滴加入10%的稀盐酸,烧杯中剩余固体的质量与加入稀盐酸的质量关系曲线如图所示,请根据题意回答问题:
(1)当滴入稀盐酸质量至图中A点时,求所得溶液中溶质的质量分数。
(2)当滴入稀盐酸质量至图中B点时,继续向烧杯中加入上述粉末状混合物至刚刚无气泡产生,求此时烧杯中钙元素质量。
(1)15%;(2)24g
解析试题分析:由题意可得,当滴入稀盐酸质量至图中A点时,盐酸与碳酸钙恰好反应,生成氯化钙和水。当滴入稀盐酸质量至图中B点时,继续向烧杯中加入上述粉末状混合物至刚刚无气泡产生,此时加入的混合物中的碳酸钙恰好与过量的盐酸反应,生成氯化钙和水。
[解] (1)当滴入稀盐酸质量至图中A点时,盐酸中氯化氢的质量为:146 g×10%="14.6" g
设样品中碳酸钠的质量为x,反应生成氯化钙的质量为y,产生二氧化碳质量为Z。
CaCO3 + 2HCl = CaCl2 + H2O + CO2↑ (1分)
100 73 111 44
x 14.6g y z x=20g
x=20g  y="22.2" g
y="22.2" g  z="8.8" g
z="8.8" g
样品中氯化钙的质量为44.2g-20g=22.2g
溶液中氯化钙的质量分数为 ×100%=15%
×100%=15%
(2)当滴入稀盐酸质量至图中B点时,继续向烧杯中加入上述粉末状混合物至刚刚无气泡产生,此时加入的混合物中的碳酸钙恰好与过量的盐酸反应,生成氯化钙和水。
溶液中氯化钙的质量为:22.2g+22.2 g+22.2g=66.6g;
溶液中钙元素的质量为:66.6g× ×100%=24g
×100%=24g
答:(1)当滴入稀盐酸质量至图中A点时,所得溶液中溶质的质量分数15%;
当滴入稀盐酸质量至图中B点时,继续向烧杯中加入上述粉末状混合物至刚刚无气泡产生,此时烧杯中钙元素质量24g。
考点:根据化学方程式计算;溶液中溶质的质量分数;化合物中元素的质量。
点评:根据化学方程式计算,要注意解题的步骤,设、写、找、列、解、答。
溶液中溶质质量分数= 。
。
化合物中某元素的质量等于物质的质量乘以化合物中某元素的质量分数。

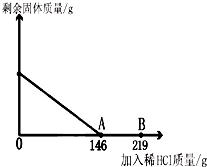 在一烧杯中盛有42.2g碳酸钙和氯化钙的粉末状混合物,向其中加入116.6g水,使氯化钙完全溶解.然后向其中逐滴加入10%的稀盐酸,烧杯中剩余固体的质量与加入稀盐酸的质量关系曲线如图所示,请根据题意回答问题:
在一烧杯中盛有42.2g碳酸钙和氯化钙的粉末状混合物,向其中加入116.6g水,使氯化钙完全溶解.然后向其中逐滴加入10%的稀盐酸,烧杯中剩余固体的质量与加入稀盐酸的质量关系曲线如图所示,请根据题意回答问题: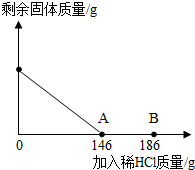 (2012?潍坊二模)在一烧杯中盛有42.2g碳酸钙和氯化钙的粉末状混合物,向其中加入116.6g水,使氯化钙完全溶解.然后向其中逐滴加入10%的稀盐酸,烧杯中剩余固体(加水溶解后剩余固体)的质量与加入稀盐酸的质量关系曲线如图所示,请根据题意完成下列问题:
(2012?潍坊二模)在一烧杯中盛有42.2g碳酸钙和氯化钙的粉末状混合物,向其中加入116.6g水,使氯化钙完全溶解.然后向其中逐滴加入10%的稀盐酸,烧杯中剩余固体(加水溶解后剩余固体)的质量与加入稀盐酸的质量关系曲线如图所示,请根据题意完成下列问题: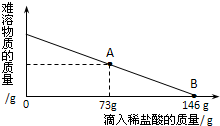 在一烧杯中盛有42.2g CaCO3和CaCl2的粉末状混合物,向其中加入188.8g水,使混合物中的可溶物完全溶解.然后再向其中逐滴加入溶质的质量分数为10%的稀盐酸,烧杯中难溶固体物质的质量与所滴入稀盐酸的质量关系曲线如图X所示:
在一烧杯中盛有42.2g CaCO3和CaCl2的粉末状混合物,向其中加入188.8g水,使混合物中的可溶物完全溶解.然后再向其中逐滴加入溶质的质量分数为10%的稀盐酸,烧杯中难溶固体物质的质量与所滴入稀盐酸的质量关系曲线如图X所示: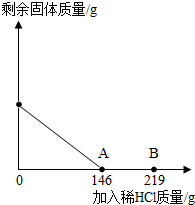 (2012?房山区一模)在一烧杯中盛有42.2g碳酸钙和氯化钙的粉末状混合物,向其中加入116.6g水,使氯化钙完全溶解.然后向其中逐滴加入10%的稀盐酸,烧杯中剩余固体的质量与加入稀盐酸的质量关系曲线如图所示,请根据题意回答问题:
(2012?房山区一模)在一烧杯中盛有42.2g碳酸钙和氯化钙的粉末状混合物,向其中加入116.6g水,使氯化钙完全溶解.然后向其中逐滴加入10%的稀盐酸,烧杯中剩余固体的质量与加入稀盐酸的质量关系曲线如图所示,请根据题意回答问题: